Wstęp
Bakterie, jako najmniejsze i najprostsze zdolne do samodzielnego życia organizmy żywe, od dawna fascynują naukowców z różnych dziedzin nauki. Niezwykła zdolność tych mikroorganizmów do poruszania się – często w odpowiedzi na subtelne zmiany w otoczeniu – otwiera fascynujące pole badań z pogranicza biologii, fizyki oraz nowoczesnych technologii.
Jednym z najbardziej szczegółowo zbadanych elementów bakteryjnego aparatu ruchu jest wić. Ten biologiczny napęd przypomina inżynieryjne systemy wykorzystywane w dzisiejszej technice – obracający się element przekształca energię chemiczną w mechaniczną, generując ruch obrotowy, który napędza komórkę w środowisku płynnym. Wydajność i skuteczność tego mechanizmu inspirują inżynierię biomimetyczną oraz nanotechnologię, a jego dogłębne zrozumienie może wpłynąć na rozwój nowoczesnych technologii napędowych i sensorycznych. Według Michała Ostrowskiego, autora artykułu Marzenie nanotechnologów: silnik protonowy bakterii Escherichia coli1, budowa wici oraz mechanizm jej działania przypominają niezwykle zaawansowaną maszynę zaprojektowaną przez człowieka. Zlokalizowany w ciałku podstawowym silnik molekularny jest zasilany gradientem protonów lub jonów sodu, co czyni go jednym z najbardziej wydajnych systemów energetycznych w przyrodzie. Ostrowski podkreśla, że zrozumienie zasady działania tego mechanizmu otwiera nowe możliwości projektowania nanomaszyn, które mogłyby funkcjonować w sposób zbliżony do układów biologicznych. W kontekście tych warto zwrócić uwagę na opracowaną przez Michaela J. Behego, autora książek Czarna skrzynka Darwina2 oraz Pułapka na Darwina3, koncepcję nieredukowalnej złożoności bakteryjnego systemu ruchu. Behe argumentuje, że wić bakteryjna jest przykładem układu, którego wszystkie elementy muszą współdziałać w sposób harmonijny, aby system mógł funkcjonować. Usunięcie jednego z elementów prowadzi do całkowitej utraty funkcji, co czyni powstanie tego systemu czymś niezwykle trudnym do wyjaśnienia w ramach neodarwinizmu. Chociaż podejście Behego jest krytykowane przez wielu biologów, jego analiza technicznych aspektów funkcjonowania wici dostarcza inspirujących analogii dla inżynierów i nanotechnologów, którzy starają się czerpać z biologii rozwiązania techniczne. Z kolei mechaniczne i strukturalne szczegóły działania wici ukazują, że jest ona nie tylko narzędziem ruchu, ale także reagującym na zmiany chemiczne i fizyczne w otoczeniu precyzyjnym systemem sensorycznym. System chemotaksji, czyli zdolność do kierunkowego ruchu w odpowiedzi na bodźce chemiczne, jest przykładem synergii między biologią, chemią i mechaniką. Receptory chemotaktyczne, takie jak MCPs (Methyl-accepting Chemotaxis Proteins), wykrywają zmiany w stężeniu bodźców chemicznych, a skomplikowany układ sygnalizacyjny precyzyjnie kontroluje kierunek obrotu wici, umożliwiając bakteriom nawigację w kierunku korzystnych dla niej warunków4.
Wszystkie te elementy – od napędzanego protonami molekularnego silnika, przez strukturalną złożoność wici, po zdolność do adaptacji sensorycznej – łączą się w jeden z najbardziej fascynujących układów biologicznych. Próba zrozumienia tych mechanizmów na poziomie inżynieryjnym dostarcza nie tylko wiedzy o funkcjonowaniu życia na poziomie komórkowym, ale również inspiruje rozwój technologii.
Budowa i funkcje wici bakteryjnej
Aby w pełni zrozumieć mechanikę działania i funkcjonalność wici bakteryjnej, konieczne jest zgłębienie jej budowy molekularnej. Struktury takie jak filament, haczyk czy ciałko podstawowe odgrywają kluczowe role w tym precyzyjnym systemie ruchu. Szczegółowa analizie tych elementów pozwala lepiej zrozumieć ich synergiczne działanie oraz znaczenie w adaptacji bakterii do dynamicznie zmieniającego się środowiska.
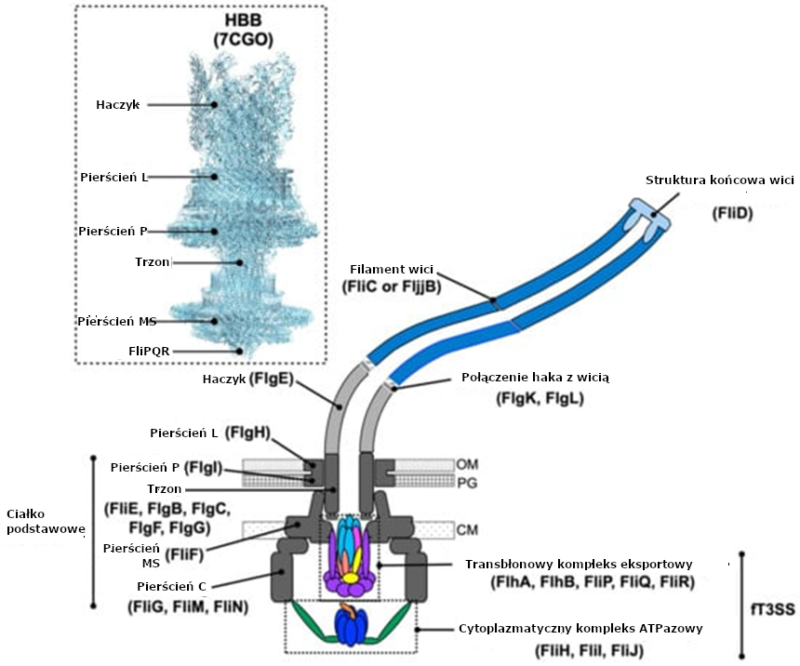
Wić bakteryjna składa się z trzech podstawowych części:
- Filament – zewnętrzna, spiralna struktura pełniąca funkcję „śruby napędowej”.
- Haczyk – elastyczne połączenie przenoszące moment obrotowy z silnika na filament.
- Ciałko podstawowe – silnik molekularny zakotwiczony w błonach komórkowych, odpowiadający za generowanie momentu obrotowego5.
Każda z tych części pełni wyspecjalizowaną funkcję i jest zbudowana ze współpracujących w precyzyjny sposób białek, umożliwiając sprawne funkcjonowanie wici.
Budowa i funkcje filamentu
Filament wici bakteryjnej to najbardziej charakterystyczna część wici, stanowiąca długi, helikalny element wystający na zewnątrz komórki. Jest to kluczowy komponent uczestniczący w realizacji ruchu bakterii, przekształcający moment obrotowy generowany przez silnik wiciowy w efektywną siłę napędową działającą na komórkę. Filament jest strukturą rurkowatą o średnicy około 20 nanometrów i długości od kilku do kilkunastu mikrometrów (w zależności od gatunku bakterii). Jego głównym składnikiem są białka flageliny (FliC), które tworzą powtarzające się jednostki w układzie helikalnym. Białko to charakteryzuje się zdolnością do samodzielnego montażu, co pozwala na dynamiczną odbudowę filamentu w przypadku jego uszkodzeń. Wnętrze filamentu jest puste, co umożliwia transport podjednostek flageliny przez kanał centralny od ciałka podstawowego do końca filamentu6. Proces montażu filamentu przypomina mechanizm montażu rury teleskopowej – nowe podjednostki są dodawane na końcu filamentu, co pozwala na jego wydłużanie się w zorganizowany sposób. Istotna dla motorycznej funkcji filamentu jest jego struktura helikalna. Kąt skrętu i promień helisy mogą różnić się między gatunkami bakterii, co wpływa na charakterystykę ruchu w różnych środowiskach. Dzięki temu filament może generować różne rodzaje ruchu, dostosowane do specyficznych warunków środowiskowych, takich jak woda czy śluz7.
Główną funkcją filamentu jest wykonywanie ruchu obrotowego bakterii. Obrót filamentu, napędzany przez silnik wiciowy umieszczony w ciałku podstawowym, prowadzi do oddziaływania z otaczającym płynem i w konsekwencji do przemieszczania się komórki. W zależności od kierunku obrotu filament może działać w trybie ruchu prostoliniowego oraz w trybie ruchu chaotycznego, co zostanie dokładniej omówione w dalszej części tekstu. Filament odgrywa również rolę w interakcji bakterii z otoczeniem. W niektórych przypadkach flagelina może działać jako element zwiększający zdolność bakterii do wywoływania chorób, aktywując układ immunologiczny gospodarza i wyzwalając reakcję zapalną. Dodatkowo, u niektórych gatunków bakterii, filament uczestniczy w procesach adhezji, umożliwiając przyczepienie się bakterii do powierzchni biologicznych lub abiotycznych8.
Filament wici jest niezbędnym elementem ruchu bakterii i adaptacji do zmieniających się warunków środowiskowych. Jego zdolność do odbudowy sprawia, że bakterie mogą przetrwać w trudnych warunkach i skutecznie poszukiwać korzystnych dla siebie środowisk. Struktura filamentu stanowi również inspirację dla nanotechnologii, gdzie elastyczne i jednocześnie wytrzymałe struktury mogą znaleźć zastosowanie w projektowaniu nowoczesnych systemów napędowych9.
Budowa i funkcje haczyka
Haczyk wici bakteryjnej to kluczowy element strukturalny, który pełni rolę przegubu łączącego ciałko podstawowe z filamentem. Ta wysoce zorganizowana struktura jest zbudowana z powtarzających się podjednostek białkowych, głównie FlgE, które tworzą elastyczną i jednocześnie wytrzymałą strukturę helikalną. Budowa haczyka umożliwia przenoszenie momentu obrotowego generowanego przez ciałko podstawowe na filament, co jest niezbędne do skutecznego napędzania bakterii w płynnym środowisku. Elastyczność haczyka pozwala na zginanie się w szerokim zakresie kątów, co zapobiega uszkodzeniom filamentu w wyniku działania sił mechanicznych. Dzięki temu haczyk działa jak uniwersalny przegub, który nawet w zmiennych warunkach środowiskowych utrzymuje synchronizację obrotów między ciałkiem podstawowym a filamentem10. Funkcja haczyka nie ogranicza się jedynie do przenoszenia momentu obrotowego pomiędzy ciałkiem podstawowym a filamentem. Element ten odgrywa również kluczową rolę w procesie montażu wici, który – mimo że prowadzi do powstania funkcjonalnie nieredukowalnego układu – przebiega w sposób ściśle sekwencyjny. Po uformowaniu ciałka podstawowego następuje synteza i wzrost haczyka, który po osiągnięciu określonej długości umożliwia rozpoczęcie dołączania filamentu. Dodatkowo, białko FlgE, które tworzy haczyk, wykazuje zdolność do adaptacji strukturalnej, co pozwala na zachowanie optymalnej wytrzymałości mechanicznej i elastyczności w szerokim zakresie obciążeń11.
Haczyk zapewnia nie tylko mechaniczną funkcjonalność wici, ale również przyczynia się do ogólnej efektywności ruchu bakterii. Bez niego filament wici nie mógłby obracać się w sposób zsynchronizowany z rotorem, co uniemożliwiłoby generowanie siły napędowej. Dzięki elastyczności i precyzji przenoszenia obrotu, haczyk pozwala bakteriom poruszać się zarówno w płynach o niskiej lepkości (np. wodzie), jak i w środowiskach bardziej lepkich, takich jak śluz12.
Budowa i funkcje ciałka podstawowego
Ciałko podstawowe to najbardziej złożona część wici bakteryjnej. Jest ono zakotwiczone w błonach komórkowych bakterii i wytwarza moment obrotowy. Ciałko podstawowe składa się z kilku pierścieni oraz licznych białek o różnych funkcjach:
- Pierścień MS: Znajduje się w błonie cytoplazmatycznej i pełni funkcję głównego elementu obrotowego.
- Pierścień P: Stabilizuje strukturę w ścianie komórkowej.
- Pierścień L: Obecny tylko u bakterii Gram-ujemnych, zakotwicza wić w błonie zewnętrznej.
- Pierścień C: Zawiera kompleks przełączający, który kontroluje kierunek obrotu wici.
Pierścienie motoryczny i przełączający są kluczowymi elementami molekularnej maszynerii napędzającej wić bakteryjną. Każdy z tych komponentów odgrywa unikatową rolę w generowaniu i kontrolowaniu obrotu wici, zapewniając bakteriom zdolność do adaptacji w dynamicznie zmieniających się warunkach. Kompleks motoryczny, stanowiący silnik wici, zlokalizowany jest w ciałku podstawowym, a działanie tego układu napędowego opiera się na wykorzystaniu gradientu elektrochemicznego protonów (lub jonów sodu), znanego jako siła protonomotoryczna (proton motive force – PMF).W skład silnika wici wchodzi stator, utworzony przez białka MotA i MotB, oraz rotor, składający się z elementów takich jak FliG, FliM i FliN. Stator stanowi nieruchomą strukturę zakotwiczoną w ścianie komórkowej bakterii. MotA i MotB współpracują w przepuszczaniu protonów przez błonę cytoplazmatyczną, co wyzwala zmiany konformacyjne w białkach i napędza obrót rotora. Rotor natomiast przenosi tę energię na filament wici, umożliwiając jej ruch obrotowy. Cały system działa z niemal perfekcyjną sprawnością energetyczną, pozwalając na generowanie prędkości obrotowej dochodzącej nawet do 1700 obr./s. Kompleks przełączający, stanowiący integralną część pierścienia C w ciałku podstawowym, kontroluje kierunek obrotu wici. Kompleks ten składa się z białek FliG, FliM i FliN, które współpracują ze sobą w odpowiedzi na sygnały chemotaktyczne. Kluczowym elementem regulacyjnym jest fosforylowane białko CheY-P, które wiąże się z FliM. Gdy poziom CheY-P w komórce jest wysoki, zmienia ono konformację kompleksu przełączającego, co prowadzi do obrotu wici zgodnie z ruchem wskazówek zegara. W trybie tym bakteria wykonuje ruch chaotyczny, zwany ,,tumble’’, umożliwiający zmianę kierunku. W przypadku niskiego poziomu CheY-P, obrót wici odbywa się w kierunku przeciwnym do ruchu wskazówek zegara, co skutkuje ruchem prostoliniowym ruchem (,,run’’). Synergia między kompleksem motorycznym a przełączającym stanowi podstawę skutecznego ruchu wici bakteryjnej. Energetyczna efektywność napędu, w połączeniu z precyzyjną kontrolą kierunku obrotu, umożliwia bakteriom szybkie reagowanie na zmiany środowiskowe, takie jak gradienty chemiczne. System ten inspiruje również badania nad nanotechnologią, szczególnie w obszarach mikrorobotyki i projektowania sztucznych silników molekularnych13.
Chemotaksja
Chemotaksja to proces, w którym bakterie wykrywają i reagują na gradienty chemiczne w środowisku, kierując swój ruch w stronę korzystnych substancji (np. składników odżywczych) lub z dala od substancji szkodliwych (np. toksyn). Mechanizm ten opiera się na skomplikowanym układzie sensorycznym i sygnalizacyjnym, który integruje bodźce zewnętrzne z wewnętrzną kontrolą ruchu wici bakteryjnej.
Chemotaksja składa się z kilku kluczowych elementów:
- Receptory chemotaktyczne (MCPs, Methyl-accepting Chemotaxis Proteins) znajdują się w błonie cytoplazmatycznej bakterii. MCPs umożliwiają bakteriom wykrywanie zmian w składzie chemicznym środowiska, takich jak obecność aminokwasów, cukrów czy substancji szkodliwych i odpowiednie dostosowanie kierunku ruchu. Każdy receptor jest specyficzny dla określonego rodzaju bodźca chemicznego. Receptory chemotaktyczne są zdolne do odbierania sygnałów nawet przy minimalnych różnicach w stężeniach bodźców chemicznych, co czyni je niezwykle czułymi narzędziami detekcji.
- Kinaza sygnalizacyjna CheA (Chemotaxis protein A). MCPs są połączone z białkiem kinazowym CheA za pomocą białka adapterowego CheW. Kinaza CheA jest odpowiedzialna za fosforylację białek efektorowych w odpowiedzi na sygnały odbierane przez receptory MCPs.
- Białka sygnalizacyjne CheY (Chemotaxis protein Y) i CheB (Chemotaxis protein B). Fosforylowane białko CheY wiąże się z pierścieniem C w ciałku podstawowym wici, zmieniając kierunek jej obrotu. CheB uczestniczy w procesie adaptacji receptorów chemotaktycznych poprzez usuwanie grup metylowych z MCPs.
- System adaptacyjny CheR i CheB (Chemotaxis proteins R and B). CheR (metylotransferaza) dodaje grupy metylowe do MCPs, zwiększając ich wrażliwość, podczas gdy CheB (demetylaza) usuwa te grupy, umożliwiając bakteriom adaptację do długotrwałego narażenia na określony bodziec14.
Główną funkcją chemotaksji jest umożliwienie bakterii nawigacji w zmiennym środowisku, co zwiększa jej szanse na przetrwanie i reprodukcję. Proces ten odbywa się poprzez dwa kluczowe mechanizmy ruchu wici:
- Ruch prostoliniowy (run): wić obraca się przeciwnie do ruchu wskazówek zegara, co prowadzi do uformowania wiązki wici i ruchu bakterii w określonym kierunku.
- Ruch chaotyczny (tumble): wić obraca się zgodnie z ruchem wskazówek zegara, co powoduje rozpad wiązki i losową zmianę kierunku.
Chemotaksja umożliwia bakteriom podążanie za gradientami chemicznymi w sposób dynamiczny i precyzyjny. Dzięki mechanizmowi adaptacji receptory MCPs są w stanie reagować na zmiany w stężeniach bodźców, a nie na ich bezwzględny poziom, co pozwala bakteriom efektywnie poruszać się w kierunku optymalnych warunków środowiskowych15.
Chemotaksja odgrywa kluczową rolę w funkcjonowaniu bakterii. Pozwala im unikać toksycznych substancji i efektywnie wykorzystywać zasoby odżywcze. Mechanizm ten jest również istotny w kontekście chorobotwórczości niektórych gatunków bakterii, takich jak Helicobacter pylori czy Escherichia coli, u których chemotaksja umożliwia kolonizację specyficznych środowisk w organizmie gospodarza, które sprzyjają ich przetrwaniu i namnażaniu. Zdolność do ruchu w odpowiedzi na bodźce chemiczne daje bakteriom znaczną przewagę adaptacyjną16.
Wykaz białek wchodzących w skład wici.
|
Lp. |
Nazwa białka |
Funkcja białka |
|
Białka strukturalne (szkielet wici) |
||
|
1 |
FliC (flagelina) |
Buduje filament wici, tworząc helikalną strukturę działającą jak śruba napędowa, przekształcając ruch obrotowy w siłę napędową. |
|
2 |
FliD |
Tworzy kapturek montażowy na szczycie filamentu, stabilizując proces dodawania nowych monomerów flageliny. |
|
3 |
FlgE: |
Buduje haczyk, elastyczne połączenie między filamentem a ciałkiem podstawowym, umożliwiające przenoszenie momentu obrotowego. |
|
4 |
FlgK |
Łączy haczyk z filamentem, zapewniając integralność strukturalną wici. |
|
5 |
FlgL |
Współpracuje z FlgK, wzmacniając połączenie haczyka z filamentem. |
|
6 |
FliF |
Tworzy pierścień MS w błonie cytoplazmatycznej, będący platformą montażową dla innych elementów wici. |
|
7 |
FlgI |
Buduje pierścień P stabilizujący wić w ścianie komórkowej. |
|
8 |
FlgH |
Tworzy pierścień L zakotwiczający wić w błonie zewnętrznej u bakterii Gram-ujemnych. |
|
9 |
FliG |
Część kompleksu przełączającego w pierścieniu C, odpowiada za generowanie momentu obrotowego. |
|
10 |
FliM |
Część pierścienia C, uczestniczy w regulacji kierunku obrotu wici. |
|
11 |
FliN |
Stabilizuje kompleks przełączający, wspomagając interakcje z sygnałami chemotaktycznymi. |
|
Białka motoryczne (napęd wici) |
||
|
12 |
MotA |
Tworzy kanał protonowy, umożliwiając przepływ jonów H+ i generowanie siły napędowej. |
|
13 |
MotB |
Stabilizuje kompleks motoryczny, współpracuje z MotA w konwersji energii elektrochemicznej na ruch mechaniczny. |
|
14 |
PomA |
Analog MotA u bakterii napędzanych gradientem sodu, tworzący kanał jonowy. |
|
15 |
PomB |
Analog MotB u bakterii wykorzystujących gradient sodu, stabilizuje kompleks motoryczny. |
|
16 |
MotX |
Wspiera działanie kompleksu motorycznego u bakterii morskich. |
|
17 |
MotY |
Stabilizuje kompleks motoryczny u bakterii w specyficznych środowiskach. |
|
Białka eksportowe (transport białek do rosnącej wici) |
||
|
18 |
FliI |
ATPaza eksportowa, dostarcza energii do transportu białek przez kanał centralny wici. |
|
19 |
FliR |
Element systemu eksportowego, transportuje monomery białek strukturalnych. |
|
20 |
FlhA |
Uczestniczy w transporcie białek strukturalnych przez błonę cytoplazmatyczną. |
|
21 |
FlhB |
Reguluje eksport białek strukturalnych, kontrolując ich transport przez kanał centralny. |
|
22 |
FliJ |
Stabilizuje działanie ATPazy FliI, wspomagając transport białek. |
|
23 |
FliP |
Element systemu eksportowego, umożliwiający precyzyjne przesyłanie białek. |
|
24 |
FliQ |
Uczestniczy w eksporcie białek do miejsca montażu wici. |
|
25 |
FliR |
Tworzy kanał eksportowy dla monomerów flageliny. |
|
Białka montażowe i regulacyjne |
||
|
26 |
FlgD |
Uczestniczy w montażu haczyka, zapewniając jego prawidłowe połączenie z ciałkiem podstawowym. |
|
27 |
FliK |
Reguluje długość haczyka, zapobiegając nadmiernemu wydłużeniu. |
|
28 |
FlgM |
Regulator transkrypcji genów flageliny, zapobiega przedwczesnej syntezie filamentu. |
|
29 |
FlhC |
Regulator transkrypcji genów wici, aktywuje ekspresję białek strukturalnych. |
|
30 |
FlhD |
Współpracuje z FlhC w regulacji genów wici. |
|
Białka chemotaktyczne (kontrola ruchu w odpowiedzi na bodźce) |
||
|
31 |
CheA |
Kinaza, przekazuje sygnały chemotaktyczne do kompleksu przełączającego. |
|
32 |
CheY |
Przekaźnik sygnałów chemotaktycznych, zmienia kierunek obrotu wici. |
|
33 |
CheW |
Łączy receptory chemotaktyczne MCP z kinazą CheA. |
|
34 |
CheR |
Metylotransferaza, reguluje wrażliwość receptorów MCP na bodźce chemiczne. |
|
35 |
CheB |
Demetylaza, zmniejsza wrażliwość receptorów MCP, umożliwiając adaptację. |
|
36 |
CheZ |
Defosforyluje CheY, regulując czas trwania odpowiedzi chemotaktycznej. |
|
37 |
CheV |
Pomocnicze białko adaptacyjne, występuje w specyficznych gatunkach. |
|
Dodatkowe białka pomocnicze |
||
|
38 |
FliO |
Stabilizuje system eksportowy, zapewniając prawidłowe funkcjonowanie FliI. |
|
39 |
FliH |
Wspiera ATPazę FliI, ułatwiając transport białek strukturalnych. |
|
40 |
FlgN |
Bierze udział w montażu haczyka. |
|
41 |
FliS |
Chaperon w procesie montażu wici bakteryjnej, stabilizuje monomery flageliny (FliC) i transportuje je do aparatu eksportowego, gdzie są one wydzielane na zewnątrz i wbudowywane w filament. |
|
42 |
FlgX |
Stabilizuje struktury pierścienia L. |
|
43 |
FlgZ |
Reguluje transport jonów w pobliżu wici. |
|
Specyficzne dla niektórych bakterii (opcjonalne) |
||
|
44 |
Tap |
Receptor chemotaktyczny MCP dla aminokwasów. |
|
45 |
Tsr |
Receptor MCP dla seriny. |
|
46 |
Tar |
Receptor MCP dla asparaginy i maltotriozy. |
|
47 |
Trg |
Receptor MCP dla rybozy i galaktozy. |
|
48 |
Aer |
Receptor tlenowy, odpowiedzialny za aerotaksję. |
|
49 |
FliL |
Stabilizuje ruchome części wici. |
|
50 |
FlgB |
Białko wspomagające montaż pierścienia MS. |
Wykaz sporządzony na podstawie: H.C. Berg, E. coli, s. 48–55, 60–70; G.H. Wadhams, Making Sens, s. 1024–1037; R.M. Macnab, How Bacterias. 81-85,89-92; S. Kojima, D.F. Blair, The Bacterial Flagellar Motor, s. 95–100, 105–110; T. Minamino, K. Imada, The Bacterial Flagellar Motor and its Structural Diversity, ,,Trends in Microbiology’’ 2015, Vol. 23, No. 3, s. 161–170; N.R. Francis et al., Isolation, Characterization, and Structure of Bacterial Flagellar Motors Containing the Switch Complex, ,,Journal of Molecular Biology’’ 1994, Vol. 235, No. 4, s. 1265–1268; Protein Data Bank (PDB), ,,RCSB PDB Protein Data Bank’’ [dostęp: 15 XII 2024].
Znaczenie biologiczne wici bakteryjnych
Wić bakteryjna jest nie tylko strukturą umożliwiającym ruch, ale również pełni szereg istotnych funkcji biologicznych, które mają kluczowe znaczenie dla przetrwania i adaptacji bakterii w różnorodnych środowiskach. Jej wszechstronność sprawia, że odgrywa istotną rolę zarówno w procesach ekologicznych, jak i patogennych.
Wić odgrywa główną rolę w zdolności bakterii do eksplorowania otoczenia i poszukiwania optymalnych warunków środowiskowych. Dzięki zdolności do wykrywania i reagowania na gradienty chemiczne, bakterie mogą poruszać się w kierunku korzystnych substancji, takich jak składniki odżywcze, oraz unikać substancji toksycznych. Wici umożliwiają również bakterii przetrwanie w niesprzyjających warunkach, pozwalając jej na migrację w kierunku obszarów o bardziej stabilnych parametrach środowiskowych, takich jak temperatura, pH czy dostępność wody17. Wici pełnią także kluczową rolę w procesie adhezji bakterii do powierzchni, co sprzyja powstawaniu biofilmów. Biofilmy to złożone struktury bakteryjne, które zapewniają ochronę przed niekorzystnymi warunkami środowiskowymi, takimi jak antybiotyki czy środki dezynfekujące. Ruch wici umożliwia bakteriom aktywne dotarcie do powierzchni, a następnie ich przyczepienie się do podłoża dzięki dodatkowym strukturom adhezyjnym, takim jak fimbrie. Powstanie biofilmu zapewnia bakteriom wspólne środowisko sprzyjające wymianie genetycznej, ochronie przed stresem fizjologicznym oraz skuteczniejszemu wykorzystywaniu zasobów. Biofilmy są szczególnie istotne w środowiskach wodnych, ale również w organizmach gospodarzy, gdzie mogą przyczyniać się do rozwoju infekcji. W przypadku bakterii patogennych wić stanowi kluczowy element umożliwiający kolonizację i inwazję w organizmie gospodarza. Przykładem jest Helicobacter pylori, która wykorzystuje ruch wici do penetracji warstw śluzowych żołądka, docierając do błony śluzowej, gdzie znajduje korzystniejsze warunki do przetrwania. Podobnie inne patogeny, takie jak Salmonella czy Vibrio cholerae, używają wici do przemieszczania się w organizmie gospodarza, co pozwala unikać mechanizmów obronnych układu immunologicznego18. Wici bakteryjne biorą również udział w procesie zwiększenia efektywności metabolicznej bakterii. Dzięki możliwości szybkiego przemieszczania się w kierunku źródeł pokarmu, bakterie mogą skuteczniej wykorzystywać dostępne zasoby energetyczne. Ruch umożliwia im unikanie konkurencji z innymi mikroorganizmami, pozwalając na zajmowanie bardziej korzystnych nisz ekologicznych. Wić pomaga także w unikaniu warunków, które mogłyby hamować aktywność metaboliczną, takich jak niskie stężenie tlenu w środowisku19.
Marcin Greszata
Stypendysta VI edycji konkursu stypendialnego Fundacji En Arche
Źródło zdjęcia: Pixabay
Ostatnia aktualizacja strony: 23.7.2025
Przypisy
- Por. M. Ostrowski, Marzenie nanotechnologów: silnik protonowy bakterii Escherichia coli, ,,Na Początku…” 2003, nr 9–10 (172–173), s. 328–342.
- Por. M.J. Behe, Czarna skrzynka Darwina. Biochemiczne wyzwanie dla ewolucjonizmu, tłum. D. Sagan, „Seria Inteligentny Projekt”, Fundacja En Arche, Warszawa 2020.
- Por. Tenże, Pułapka na Darwina. Michael J. Behe odpowiada krytykom, tłum. D. Sagan, ,,Seria Inteligentny Projekt”, Fundacja En Arche, Warszawa 2023.
- Por. G.H. Wadhams, J.P. Armitage, Making Sense of it all: Bacterial Chemotaxis, ,,Nature Reviews Molecular Cell Biology’’ 2004, Vol. 5, No. 12, s. 1024–1037, https://doi.org/10.1038/nrm1524.
- Por. H.C. Berg, E. coli in Motion, Springer, Berlin 2003, s. 70.
- Por. H.C. Berg, E. coli, s. 87–88.
- Por. R.M. Macnab, How Bacteria Assemble Flagella, ,,Annual Review of Microbiology’’ 2003, Vol. 57, s. 81–85, https://doi.org/10.1146/annurev.micro.57.030502.090832.
- Por. H.C. Berg, E. coli, s. 39–46.
- Por. tamże.
- Por. tamże, s. 39–40, 97–98.
- Por. R.M. Macnab, How Bacteria, s. 81–85.
- Por. H.C. Berg, E. coli, s. 50–53.
- Por. S. Kojima, D.F. Blair, The Bacterial Flagellar Motor: Structure and Function of a Complex Molecular Machine, ,,International Review of Cytology’’ 2004, Vol. 233, s. 93–134; H.C. Berg, E. coli, s. 77–88, 105–113.
- Por. H.C. Berg, E. coli, 77–88.
- Por. tamże.
- Por. G.H. Wadhams, Making sens, s. 1025–1026.
- Por. tamże.
- Por. J.W. Costerton, P.S. Stewart, E.P. Greenberg, Bacterial Biofilms: a Common Cause of Persistent Infections, ,,Science’’ 1999, Vol. 284, No. 5418, s. 1318–1322.
- Por. H.C. Berg, E. coli, s. 61–66, Por. J. Haiko, B. Westerlund-Wikström, The Role of the Bacterial Flagellum in Adhesion and Virulence, ,,Biology” 2013, Vol. 2, No. 4, s. 1242–1267, https://doi.org/10.3390/biology2041242.