Poznanie przebiegu dziejów życia na Ziemi jest jednym z największych wyzwań nauki. Odpowiedź na pytanie, skąd przybyliśmy, fascynuje od dawien dawna. Ale nie chodzi tylko o ciekawość – czasami wyjaśnienie procesów ewolucji może skutkować poznaniem mechanizmów związanych z chorobami i regeneracją narządów.
Wyjście z wody na ląd, czyli historia, którą znamy
Historia opanowania lądów przez kręgowce jest stosunkowo dobrze poznana. Wydaje się, że dobór naturalny działał na rzecz osobników sprawniej poruszających się w płytkiej wodzie i na suchym lądzie. Dzięki temu płetwy piersiowe przekształciły się w kończyny pięciopalczaste, zaś pas miednicowy rozrósł się i połączył z jednym z kręgów, dając tym samym lepsze oparcie dla kończyn. Jednak oddychanie na lądzie mogło sprawiać ówczesnym czworonogom trudności. Na szczególne podkreślenie zasługuje proces pozbywania się CO2. Woda jest dobrym odbiorcą dwutlenku węgla, natomiast trudniej z niej uzyskiwać tlen. Dlatego skrzela ryb, a zwłaszcza blaszki skrzelowe rozwinęły system doskonałej ekstrakcji tlenu – nawet do 90 procent – z opłukującej je wody. Ruchy oddechowe ryb są sterowane ilością tlenu zawartego we krwi. Na lądzie natomiast ilość CO2 osiąga w narządach oddechowych wysokie stężenie, przez co to jego poziom reguluje ruchy oddechowe kręgowców lądowych – wysoki poziom dwutlenku węgla może prowadzić do zakwaszenia krwi (w pewnym stopniu przeciwdziała temu wysoki poziom węglanów metali). To klasyczny opis tego procesu zawarty w podręcznikach1. Jednak najnowsze doniesienia naukowe wskazują, że fenomen „wyjścia z wody” mógł przebiegać inaczej, niż się to powszechnie przyjmuje.
5 vs 500, czyli nieciągłe stany równowagi według Stephena Jaya Goulda
Aby zrozumieć proces ewolucji, wypada zacząć od analizy danych kopalnych, jaką przeprowadził wybitny amerykański paleontolog z Uniwersytetu Harvarda, profesor Stephen Jay Gould (1941–2002). Zwrócił on uwagę na niezwykłe wydarzenie, które w naszym ludzkim rozumieniu trwało niebywale długo, jednak w skali geologicznej było chwilą. Mowa o kambryjskiej eksplozji gatunków, która zaczęła się około 530 milionów lat temu. To właśnie wtedy, zdaniem Goulda, życie otrzymało impuls do największego rozkwitu, który trwał „zaledwie” pięć milionów lat. Wówczas pojawiły się wszystkie podstawowe elementy organizacji zwierząt o budowie wielokomórkowej, co więcej, zaszło to w sposób nieciągły i jednorazowy, nie zaś – jak powszechnie sądzono – poprzez stopniową akumulację2. Po tym okresie nastąpiło „500 milionów lat różnicowania anatomicznego”. To właśnie podczas kambryjskiego „festiwalu twórczości” powstały wszystkie podstawowe plany budowy ciała w niewiarygodnie – z punktu widzenia teorii ewolucji – krótkim czasie3.
Kolejnym niezwykłym wydarzeniem było wymarcie większości form zwierzęcych tego „festiwalu twórczości”. Tylko nielicznym udało się przetrwać i dać początek głównym typom budowy istniejących obecnie zwierząt. Jeśli przyjmiemy, że kambryjska różnorodność dorównywała dzisiejszej, to wydaje się, że upływ kolejnych kilkuset nie doprowadził do powiększenia kambryjskiego „festiwalu twórczości”. Co więcej, nie widać żadnych charakterystycznych i wspólnych cech ewolucyjnych zwycięzców, które zadecydowały o ich przetrwaniu. Gould określił ten okres mianem największej loterii, jaka odbyła się na Ziemi4. Loteria nie ominęła oczywiście strunowców, które również wyciągnęły szczęśliwy los. Należy również podkreślić, że ten wyjątkowy, pięciomilionowy „festiwal twórczości” poprzedziły trzy miliardy lat jednokomórkowości!
Tak historię życia przedstawiają zapisy kopalne. Teraz chciałbym się skupić, opierając się na najnowszych danych naukowych i własnych obserwacjach, na kluczowym wydarzeniu w życiu zwierząt kręgowych, jakim niewątpliwie było wyjście z wody na ląd.
Egzaptacje i innowacje krytyczne
Aby w pełni zrozumieć proces opanowania lądów przez pierwsze kręgowce, warto przybliżyć kilka terminów z nim związanych. Pojęcie egzaptacji zostało wprowadzone do literatury naukowej przez profesora Goulda5, a następnie uzupełnione o „innowacje krytyczne” przez profesora Iana Tattersalla, wybitnego amerykańskiego paleoantropologa, kustosza Amerykańskiego Muzeum Historii Naturalnej w Nowym Jorku, absolwenta Uniwersytetu Yale6. Terminy te rzucają zupełnie nowe światło na procesy ewolucyjne.
Wymienieni autorzy zasugerowali, że wiele nowych przystosowań pojawia się jako egzaptacje, czyli cechy wykształcone w określonych warunkach środowiskowych (niekiedy bardzo dawno) i dopiero później wykorzystane do innych celów. Inaczej mówiąc, egzaptacje są cechami, które pojawiły się i mogą być ewentualnie użyteczne w realizacji jakiejś nowej funkcji (w przyszłości)7. Natomiast innowacja krytyczna powstaje, gdy w wyniku przypadkowego zestawienia istniejących wcześniej cech pojawia się zupełnie nowa struktura u danego organizmu. W połączeniu z egzaptacjami innowacje krytyczne stanowią potężny mechanizm ewolucyjny8.
Z wody na ląd – najnowsze fakty
Jak już wspomniałem, opanowanie lądów przez zwierzęta kręgowe było jednym z najważniejszych wydarzeń w ciągu prawie czterech miliardów lat ewolucji życia na Ziemi. Dane kopalne wskazują, że ekspansja kręgowców na ląd nastąpiła około 500 do 600 milionów lat temu. Wyjście z wody na ląd wiązało się z wieloma przystosowaniami do nowego środowiska życia. Jednym z nich było wykształcenie narządów służących do oddychania powietrzem, które jest przykładem ewolucji równoległej, czyli powstawało wielokrotnie u różnych grup ryb (często niespokrewnionych) występujących w podobnych środowiskach9. Jednak gdzie szukać wyjaśnienia tej jednej z największych zagadek historii życia kręgowców? Czy w ogóle uda nam się ją odnaleźć? Pomimo kolejnych odkryć paleontologii musimy przyznać, że ta dziedzina wiedzy nie da, niestety, wszystkich odpowiedzi na nurtujące nas pytania. W skamieniałościach nie zachowały się bowiem tkanki miękkie, szczególnie płuc, więc nie ma możliwości odtworzenia tej niezwykle delikatnej struktury pierwszych narządów oddechowych10. Nie pozostaje nam zatem nic innego, jak tylko badanie gatunków ryb żyjących współcześnie i na tej podstawie dokonywanie pewnych uogólnień11.
Budowa naszych płuc
Aby w pełni zrozumieć, w jaki sposób odbywała się i nadal odbywa wymiana gazowa, a tym samym uświadomić sobie, z jakimi problemami przyszło zmierzyć się dawnym organizmom przechodzącym z oddychania skrzelami typowego dla ryb na oddychanie powietrzem, warto przybliżyć budowę płuc ssaków. W płucach człowieka wymiana oddechowa odbywa się w pęcherzykach płucnych. Szacuje się, że w naszych płucach liczba pęcherzyków wynosi około 300 milionów (w obu płucach) oraz że powierzchnia wymiany gazowej wynosi około 100 metrów kwadratowych, co czyni ją porównywalną z powierzchnią kortu tenisowego.
Ścianę pojedynczego pęcherzyka płucnego pokrywa nabłonek oddechowy umożliwiający dyfuzję (przenikanie) gazów. Nabłonek ten jest zbudowany z dwóch typów komórek określanych jako pneumocyty typu I i II12. Pierwsze z nich są płaskimi komórkami stanowiącymi 95 procent wyściółki pęcherzyków płucnych. W ich budowie wyróżniamy korpus komórki, w którym mieści się jądro, oraz silnie spłaszczone wypustki cytoplazmy. Niezwykle istotne jest usytuowanie włosowatych naczyń krwionośnych pomiędzy korpusami komórek nabłonka, przez co wytwarza się niezwykle cienka bariera oddzielająca wnętrze naczynia włosowatego z erytrocytami (czerwone ciałka krwi) od wnętrza płuc wypełnionych powietrzem. Jak cienkie i delikatne są pneumocyty typu I może świadczyć porównanie ich do kartki papieru, od której są 250 razy cieńsze. Taka budowa idealnie przyczynia się do wymiany gazowej13.
Natomiast pneumocyty typu II są komórkami o cylindrycznym (walcowatym) kształcie. Ich charakterystyczną cechą jest występowanie w cytoplazmie ciałek lamellarnych będących magazynem surfaktantu (czynnika powierzchniowo czynnego). Po wydostaniu się z pneumocytów typu II surfaktant tworzy delikatną warstwę pokrywającą wnętrze pęcherzyka płucnego. Bez niego pęcherzyki nie są w stanie utrzymać swojej budowy ani prawidłowo funkcjonować. Surfaktant zmniejsza napięcie powierzchniowe, zabezpiecza przed toksycznym działaniem gazów – jednym słowem umożliwia przenikanie gazów, w tym tlenu, do wnętrza włosowatych naczyń krwionośnych14.
Ryby oddychające powietrzem, czyli zabawa w detektywa
Skoro wykopaliska nie pomogą nam w określeniu struktury pierwszych narządów służących kręgowcom do oddychania powietrzem, nie zostaje nic innego, jak tylko skupić się na badaniach gatunków ryb żyjących współcześnie korzystających z dodatkowych organów oddechowych. Do dzisiaj opisano około 400 takich gatunków. W większości są to gatunki tropikalne żyjące w słodkich wodach charakteryzujących się okresowym występowaniem stanów wodnej hipoksji (niedotlenienia)15. Wszystkie dodatkowe narządy oddechowe opisane u tych ryb charakteryzują się występowaniem płaskiego nabłonka (wspomniane już pneumocyty) umożliwiającego dyfuzję gazów oraz gęstą siecią naczyń krwionośnych kapilarnych usytuowanych tuż pod nim. Obie te cechy występują jednocześnie16. Autorzy badający dodatkowe narządy oddechowe koncentrują się głównie na opisie miejsca występowania nabłonka oddechowego. Sugerują jednocześnie, że jest on stale obecny, umożliwiając tym samym dyfuzję gazów17.
O ile płaski nabłonek oddechowy jest faktycznie stałą wyściółką takich organów służących rybom do oddychania – jak płuca ryb dwudysznych i wielopłetwców, pęcherze oddechowe, uchyłki jamy skrzelowej czy worki powietrzne18 – o tyle w przypadku przewodu pokarmowego sytuacja wygląda zgoła odmiennie19. Gatunki ryb wykorzystujące przewód pokarmowy jako dodatkowy narząd oddechowy wydają się szczególnie atrakcyjne. Jednak powstaje pytanie, w jaki sposób udaje się im pogodzić funkcję oddechową z pokarmową? Ta ostatnia wymaga nabłonka kolumnowego (walcowatego), który standardowo wyścieła przewód pokarmowy ryb. Taki nabłonek stanowi skuteczną barierę dla dyfuzji gazów, udaremniając tym samym oddychanie, które jest możliwe tylko i wyłącznie dzięki nabłonkowi płaskiemu zbudowanemu z pneumocytów.
Badania żołądka glonojada Ancistrus multispinnis (Couvier et Valenciennes), przeprowadzone z wykorzystaniem mikroskopu świetlnego i elektronowego transmisyjnego, wykazały obecność wspomnianego nabłonka płaskiego, charakterystycznego dla wyściółki płuc kręgowców lądowych20. Ta popularna ryba akwariowa wykorzystuje żołądek jako dodatkowy narząd oddechowy w warunkach wodnej hipoksji2. Dodatkowo kolejni autorzy potwierdzili występowanie nabłonka płaskiego w przewodach pokarmowych zaadaptowanych jako dodatkowe narządy oddechowe u kolejnych gatunków21. We wszystkich przypadkach opisywana w przewodzie pokarmowym bariera powietrze–krew jest zbudowana z trzech cienkich warstw, idąc od wewnątrz: śródbłonka włosowatego naczynia krwionośnego, błony podstawnej i pokrywających ją cienkich wypustek komórek nabłonka płaskiego. Jej minimalna zmierzona grubość wynosi 0,18 µ22.
Pogodzenie funkcji trawiennej z oddechową stanowi duże wyzwanie dla ryb wykorzystujących przewód pokarmowy jako dodatkowy narząd oddechowy23. Tak cienki i delikatny nabłonek jest narażony na uszkodzenia mechaniczne powodowane cząstkami pokarmowymi i działanie kwasów występujących w przewodzie pokarmowym, zaś sugerowana przez niektórych autorów produkcja dużej ilości śluzu w celu zabezpieczenia nabłonka w znacznym stopniu utrudnia – czy wręcz uniemożliwia – przenikanie (dyfuzję) gazów. Tym samym trudno przyjąć, że jest on stale obecny w przewodzie pokarmowym tych ryb. Wydaje się, że gatunki te muszą posiadać pewne szczególne adaptacje morfologiczne i fizjologiczne24. Jednak przewód pokarmowy, ze względu na bogate unaczynienie i stałą łączność z jamą gębową, wydaje się miejscem uprzywilejowanym, w którym mogą się rozwijać powierzchnie oddechowe. Dane literaturowe, opisujące wykorzystywanie przez niektóre gatunki ryb przewodu pokarmowego jako narządu wspomagającego oddychanie w okresie niedotlenienia, informują również o niepobieraniu wówczas przez nie pokarmu25.
Na tej podstawie przyjęto hipotezę o przebudowie nabłonka (epithelial remodeling) polegającej na namnażaniu się (proliferacji) komórek nabłonka płaskiego, zachodzącym w przewodzie pokarmowym adaptowanym przez niektóre gatunki ryb jako dodatkowy narząd oddechowy w warunkach stanów niedotlenienia w wodzie26.
W celu potwierdzenia tej hipotezy została przeprowadzona seria nowatorskich badań z wykorzystaniem zaawansowanych technik immunohistochemicznych27. W efekcie wykazano zdolności do proliferacji komórek nabłonka płaskiego i tym samym jego przebudowy w przewodach pokarmowych polegającej na zastępowaniu wysokich kolumnowych komórek nabłonka przez płaskie komórki – pneumocyty28.
W kolejnych badaniach użyto technik immunohistochemicznych połączonych z mikroskopią elektronową transmisyjną do wykrywania czynnika transkrypcyjnego indukowanego przez stany niedotlenienia (hipoksję)29. Wyniki badań w pełni potwierdziły tezę o zachodzącej w warunkach wodnego niedotlenienia przebudowie nabłonka w obrębie przewodu pokarmowego tych ryb30.
Powstanie płuc kręgowców lądowych – nowe spojrzenie
Wiemy, że płuca kręgowców powstały jako uchyłek przedniej części przewodu pokarmowego. Ale jak to się odbyło oraz jaki mechanizm był za to odpowiedzialny, nadal pozostaje zagadką31. Na podstawie przeprowadzonych przez nasz zespół obserwacji wnioskujemy, że pierwsze adaptacje do oddychania powietrzem mogły polegać na tworzeniu w obrębie przedniej części przewodu pokarmowego miejsc pokrytych płaskim nabłonkiem, umożliwiających przenikanie, czyli dyfuzję gazów. Można założyć, że proces prowadzący do powstania płuc kręgowców lądowych w pierwszym etapie wiązał się z namnażaniem (proliferacją) komórek nabłonka płaskiego i stopniowym powiększaniem powierzchni oddechowej w przedniej części przewodu pokarmowego.
Musimy zatrzymać się i omówić powyższą sugestię na tle kolejnych odkryć na ten temat. Samo wykształcenie powierzchni służącej wymianie gazowej (do oddychania powietrzem) nie wystarcza. Aby można było mówić o procesie oddychania, potrzebne są jeszcze inne elementy. Jednym z nich jest substancja powierzchniowo czynna, określana mianem surfaktantu, występująca w płucach kręgowców lądowych, w tym u człowieka. Badania z 1998 roku wykazały, że surfaktant „poprzedził” pojawienie się miejsc umożliwiających wymianę gazową i powstał u ryb w przewodzie pokarmowym jako egzaptacja, zaś jego skład nie uległ większym zmianom32. Jednak niezwykle istotne jest to, że u ryb wykorzystujących przewód pokarmowy jako dodatkowy narząd oddechowy ulokował się w pneumocytach typu II33. Komórki pełnią ważną funkcję w formowaniu nabłonka oddechowego, to właśnie z nich namnażają się (proliferują) komórki nabłonka płaskiego – pneumocyty typu I odpowiedzialne za wymianę oddechową. Taki sam proces zachodzi również w naszych płucach w trakcie ich rozwoju. Połączenie (sprzężenie) tych dwóch funkcji jest niezwykłym wydarzeniem, ale to jeszcze nie wszystko.
Kolejnym istotnym wydarzeniem było utworzenie się ośrodka kontroli oddechowej, identycznego z funkcjonującym w naszym mózgu. Taki właśnie ośrodek pojawił się u minogów, bezżuchwowców (Agnatha), bezpośrednich przodków ryb34. Również i ten ośrodek powstał jako egzaptacja – można powiedzieć, że czekał na swoją kolej. Dopiero po złożeniu wymienionych elementów mamy możliwość oddychania powietrzem. Wypada podkreślić, że pojawianie się zdolności do namnażania komórek opisane u ryb wykorzystujących przewód pokarmowy do oddychania powietrzem zostało określone jako innowacja krytyczna – czynnik spinający w całość poprzednie egzaptacje35. W jej wyniku mógł powstać „zaczątek płuca” umożliwiający wymianę gazową – w tym wypadku kompensujący niedobory tlenu rozpuszczonego w wodzie. Połączenie funkcji pneumocytów typu II, polegające na produkcji czynnika powierzchniowo czynnego, ze zdolnością do namnażania się w komórkach typu I (rysunek 1) było kluczowym elementem36.
Pierwszy krok głęboko pod wodą
Pojawienie się powierzchni oddechowych w przedniej części przewodu pokarmowego u niektórych gatunków dewońskich ryb (wtedy najprawdopodobniej zaczął się ten proces) pociągnęło za sobą kolejne zmiany. Najnowsze odkrycia paleontologiczne wskazują, że wykształcenie kończyn oraz zmiany w szkielecie czaszki są następstwem przystosowania do wystawiania głowy ponad lustro wody i połykania powietrza37.
Proces formowania się kończyn krocznych kręgowców rozpoczął się więc u form wodnych, a nie – jak do tej pory sądzono – u ryb przemieszczających się pomiędzy wysychającymi zbiornikami. Kończyny wykształcone w pierwszym etapie jako „wiosła” były pomocne przy chwytaniu powietrza znad powierzchni wody. Ich adaptacja do chodzenia polegała na stopniowym wykształceniu się stawów: skokowego i nadgarstka, niezbędnych do coraz sprawniejszego poruszania się późniejszych czworonogów. Podważa to sugestię, że środowisko lądowe (małe wysychające zbiorniki wodne) było główną siłą napędową wczesnej ewolucji czworonogów. Przystosowanie do połykania powietrza również silnie oddziaływało na zmiany zachodzące w szkielecie czaszki38.
Z powyższych obserwacji wnioskujemy, że trzeba kompletnie zmienić nie tylko postrzeganie wczesnego etapu przystosowania kręgowców do opuszczenia środowiska wodnego, ale też całkowicie zmienić myślenie na ten temat. Okazuje się, że najważniejsze cechy umożliwiające ekspansję kręgowców na ląd wykształciły się u zwierząt żyjących głównie w wodzie. Adaptacje te zachodziły w dewońskich morzach.
Implikacje dla nauk biomedycznych
Powstawanie nowotworów jest jednym z najbardziej intrygujących problemów współczesnej biologii i medycyny. W 1971 roku prezydent USA Richard Nixon wprowadził po raz pierwszy termin „wojna z nowotworami” (the war on cancer). Niestety, na razie wojnę tę przegrywamy. Warto nadmienić, że nowotwory płaskonabłonkowe są jednymi z najczęściej występujących nowotworów złośliwych u człowieka. W badaniach nad rybami wykorzystującymi przewód pokarmowy do oddychania powietrzem w warunkach niedotlenienia nasz zespół wykorzystał przeciwciała używane do wykrywania aktywnych, proliferujących komórek nabłonka płaskiego, które stosuje się głównie w diagnostyce nowotworów płaskonabłonkowych39. Otrzymane wyniki (pozytywne) skłaniają do przybliżenia tematu nowotworzenia.
Dominująca teoria dotycząca nowotworów SMT [somatic mutation theory] najogólniej ujmując, zakłada, że złośliwe mutacje genów zachodzące w pojedynczej komórce prowadzą do niekontrolowanych i nieograniczonych podziałów (nowotworów). Do transformacji nowotworowych może również przyczynić się utrata przez komórki zdolności do rozpoznawania sygnałów antywzrostowych, a także zaburzenia naprawy defektów DNA, przypadkowych lub powstałych w wyniku ekspozycji na czynnik karcinogenny. Obecnie teoria SMT wyznacza główny kierunek badań eksperymentalnych nad powstawaniem nowotworów40.
Jednak w 1999 roku dwójka badaczy, profesorowie Carlos Sonnenschein i Ann Soto z Tufts University School of Medicine w Stanach Zjednoczonych, zaproponowała przeciwną do SMT teorię oddziaływania międzytkankowego TOFT [tissue organisation field theory], zgodnie z którą komórki organizmu dążą do osiągnięcia stanu docelowego, jakim jest proliferacja i przemieszczanie się41. Brak procesów proliferacji i przemieszczania jest utrzymywany przez siły oddziaływania pomiędzy tkankami i komórkami organizmu (stan równowagi dynamicznej). W przeciwieństwie do teorii SMT teoria TOFT zakłada, że u podstaw procesu nowotworowego leżą czynniki zaburzające oddziaływania pomiędzy tkankami. To właśnie powyższe czynniki, a nie mutacje (onkogeny), sprawiają, że komórki „powracają do stanu wyjściowego” i zaczynają proliferować w sposób niekontrolowany (na wzór komórek embrionalnych)42. Dotychczas nie zaproponowano jednak modelu badawczego, na którym można by w pełni potwierdzić teorię oddziaływania tkankowego (TOFT).
U badanych przez nasz zespółatunków ryb, wykorzystujących przewód pokarmowy do oddychania powietrzem, stany niedotlenienia wydają się czynnikiem rozpoczynającym kaskadę zdarzeń. Hipoksję najprawdopodobniej wykrywają wyspecjalizowane chemoreceptory, które następnie emitują sygnał do kluczowych elementów umożliwiających przywrócenie stanu domyślnego komórkom43. W efekcie prowadzi to do proliferacji komórek nabłonka płaskiego (rysunek 1)44. Jednocześnie zasugerowano, że u przebadanych gatunków ryb procesy proliferacji komórek nabłonka płaskiego są pod ścisłą kontrolą. Wydaje się, że stan lepszej dostępności tlenu hamuje proces namnażania nabłonka płaskiego. Sam mechanizm różnicowania komórek nabłonka płaskiego w przewodzie pokarmowym badanych gatunków ryb pozostaje w sferze domysłów i wymaga przeprowadzenia badań eksperymentalnych z wykorzystaniem układów o zróżnicowanym wysyceniu tlenu.
Jak wspomniałem, w przeprowadzonych badaniach z powodzeniem wykorzystano znaczniki używane do badania proliferujących komórek nowotworowych u człowieka. Wykazano zasadność ich stosowania u ryb oraz zwrócono uwagę na duplikację DNA, która występuje w przypadku nowotworów u ludzi45. U przebadanych gatunków ryb DNA jest również duplikowany. Dalsze zrozumienie procesów kontrolujących aktywność zaobserwowanych elementów ma kluczowe znaczenie dla opracowania nowych strategii diagnostycznych i terapeutycznych w wielu chorobach, takich jak nowotwory i zaburzenia naczyniowe.
Warto tutaj nadmienić, że Nagroda Nobla z dziedziny fizjologii lub medycyny, przyznana w 2019 Williamowi G. Kaelinowi Jr., sir Peterowi J. Ratcliffe’owi i Greggowi L. Semenzy za odkrycie mechanizmów molekularnych odpowiedzialnych za dostosowywanie się komórek do dostępności tlenu, potwierdza sugerowane już w 2017 roku przemiany zachodzące w przewodzie pokarmowym ryb wykorzystywanym jako dodatkowy narząd oddechowy46. Zdaniem laureatów Nagrody Nobla nasilone niedotlenieniem mechanizmy adaptacyjne obserwowane w rozwoju i progresji większości nowotworów stanowią dziś cel licznych terapii antynowotworowych i mogą być bardzo pomocne w opracowaniu terapii onkologicznych.
Wydaje się, że gatunki ryb adaptujących przewód pokarmowy jako dodatkowy narząd oddechowy w warunkach niedotlenienia są doskonałym naturalnym modelem badawczym do poznania procesów nowotworowych wpisującym się dodatkowo w teorię TOFT. Regulując ilość tlenu rozpuszczonego w wodzie, można badać zarówno czynniki stymulujące, jak również hamujące proliferację komórek nabłonka płaskiego. Eksperymentalne potwierdzenie teorii oddziaływania tkankowego wyznaczy zupełnie nowy model badań eksperymentalnych nad procesami nowotworowymi, które mogą przyczynić się do opracowania skutecznych metod terapeutycznych47.
Pneumocyty typu I stanowią główną wyściółkę pęcherzyków płucnych ssaków. U ssaków komórki te utraciły zdolność do proliferacji, a po uszkodzeniu są zastępowane przez komórki typu II odpowiedzialne głównie za produkcję surfaktantu. Przeprowadzone badania wskazują, że u ryb wykorzystujących przewód pokarmowy jako dodatkowy narząd oddechowy stany niedotlenienia indukują proliferację komórek nabłonka płaskiego typu I. Co więcej, istnieje duże prawdopodobieństwo, że mechanizm ten powstał i został utrwalony niezależnie w wielu grupach ryb. W świetle przeprowadzonych obserwacji wydaje się, że te gatunki ryb są również doskonałym naturalnym modelem do obserwacji procesów sterowania proliferacją komórek nabłonka płaskiego – pneumocytów typu I.
Bez zakończenia
Łącząc zapisy kopalne z najnowszymi wynikami badań, można stwierdzić, że pojawienie się pneumocytów typu II odegrało przełomową rolę w historii opanowania lądów przez zwierzęta kręgowe. Komórki te umożliwiły zarówno syntezę surfaktantu, jak również powstanie komórek nabłonka typu płaskiego. Dzięki temu powstały miejsca służące wymianie gazowej. Z kolei stopniowe powiększanie powierzchni oddechowej pociągnęło za sobą postępujące zmiany w szkielecie kończyn. Stany niedotlenienia były główną siłą sprawczą opisanego ciągu zdarzeń.
Tak więc to egzaptacje w połączeniu z innowacją krytyczną przyczyniły się do stopniowego wykształcenia płuc kręgowców lądowych (w tym naszych). Korzyści, jakie organizmy odnosiły dzięki nim, były tak duże, że cechy te uległy utrwaleniu i można je obserwować u ryb żyjących współcześnie. Ryby wykorzystujące przewód pokarmowy jako dodatkowy narząd oddechowy w warunkach niedotlenienia wydają się niezwykle cennym, naturalnym organizmem modelowym. Badania interakcji pomiędzy zaobserwowanymi czynnikami (rysunek 1) mogą przyczynić się do wyjaśnienia mechanizmów sterujących procesami proliferacji komórek nabłonka płaskiego.
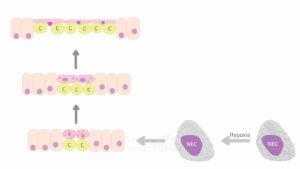
Rysunek 1. Schemat podsumowujący przebudowę nabłonka w przewodzie pokarmowym wykorzystywanym przez niektóre gatunki ryb w warunkach niedotlenienia. Niedotlenienie wodne powoduje degranulację ziarnistości w domniemanych chemoreceptorach (NEC), co wyzwala kaskadę zdarzeń. W efekcie tego procesu następuje proliferacja owalnych komórek nabłonka znajdujących się pomiędzy kolumnowymi enterocytami, połączona ze zmianą kształtu komórek – stopniowym spłaszczaniem i rozciąganiem. Kapilary (c) zbliżają się do przyszłej powierzchni oddechowej. Jednocześnie zmniejsza się liczba ciałek blaszkowatych będących magazynem surfaktantu w nich zawartych. W końcowej fazie tego procesu komórki nabłonkowe różnicują się w powiększoną część podstawną (z jądrem), znajdującą się pomiędzy naczyniami włosowatymi (c), i silnie spłaszczone wypustki. Liczne naczynia włosowate są pokryte jedynie spłaszczonymi wypustkami komórek nabłonka, tworząc w ten sposób barierę gaz–krew umożliwiającą dyfuzję gazu. Por. Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
Leszek Satora
Źródło zdjęcia: Pixabay
Ostatnia aktualizacja strony: 30.12.2022
Przypisy
- Por. H. Szarski, Historia zwierząt kręgowych, Wydawnictwo Naukowe PWN, Warszawa 2016.
- Por. S.J. Gould, Ewolucja życia na Ziemi, „Świat Nauki” 1994, nr 12, s. 61–68.
- Por. Gould, Ewolucja życia, s. 61–68.
- Por. Gould, Ewolucja życia, , s. 61–68.
- Por. S.J. Gould, E.S. Vrba, Exaptation – A Missing Term in the Science of Form, „Paleobiology” 1982, Vol. 8, No. 1, s. 4–15, https://doi.org/10.1017/S0094837300004310.
- Por. I. Tattersall, Human Evolution and Cognition, „Theory in Biosciences” 2010, Vol. 129, No. 2–3, s. 193–201, https://doi.org/10.1007/s12064-010-0093-9.
- Por. Tattersall, Human Evolution, s. 193–201.
- Por. Tattersall, Human Evolution, s. 193–201.
- Por. J.B. Graham, Air-breathing Fishes: Evolution, Diversity and Adaptation, Academic Press, San Diego – London – Boston – New York – Sydney – Tokyo – Toronto. 1997.
- Por. Graham, Air-breathing Fishes; L. Satora, T. Gawlikowski, A. Tański et al., Quest for Breathing: Proliferation of Alveolar Type 1 Cells, „Histochemistry and Cell Biology” 2022, Vol. 157, No. 4, s. 393–401, https://doi.org/10.1007/s00418-022-02073-5.
- Por. Graham, Air-breathing Fishes; L. Satora, Histological and Ultrastructural Study of the Stomach of the Air-breathing Ancistrus Multispinnis (Siluriformes, Teleostei), „Canadian Journal of Zoology” 1998, Vol. 76, No. 1, s. 83–86, https://doi.org/10.1139/z97-167.
- Por. Satora, Histological and Ultrastructural Study, s. 83–86.
- Por. Satora, Histological and Ultrastructural Study, s. 83–86; L. Satora, J. Mytych, A. Bilska-Kos et al., From Epithelial Remodeling to Carcinogenesis, „Progress in Biophysics and Molecular Biology” 2020, Vol. 150, s. 203–205, https://doi.org/10.1016/j.pbiomolbio.2019.08.001.
- Por. Satora, Histological and Ultrastructural Study, s. 83–86.
- Por. Graham, Air-breathing Fishes.
- Por. Satora, Histological and Ultrastructural Study, s. 83–86; Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
- Por. Graham, Air-breathing Fishes; J.M. Icardo, Lungs and Gas Bladders: Morphological Insights, „Acta Histochemica” 2018, Vol. 120, No 7, s. 605–612, https://doi.org/10.1016/j.acthis.2018.08.006.
- Por. Graham, Air-breathing Fishes; Icardo, Lungs and Gas Bladders, s. 605–612.
- Por. J. Mytych, K. Kozioł, L. Satora, Confirmation of the Immunoreactivity of Monoclonal Anti-human C-terminal EGFR Antibodies in Bronze Corydoras Corydoras Aeneus (Callichthyidae Teleostei) by Western Blot Method, „Acta Histochemica” 2018, Vol. 120, No. 2, s. 151–153, https://doi.org/10.1016/j.acthis.2017.12.002; Satora, Histological and Ultrastructural Study, s. 83–86; L. Satora, K. Kozioł, J. Zebrowski, Squamous Epithelium Formation in the Respiratory Intestine of the Bronze Corydoras Corydoras Aeneus (Callichthyidae Teleostei), „Acta Histochemica” 2017, Vol. 119, No. 5, s. 563–568, https://doi.org/10.1016/j.acthis.2017.05.010; L. Satora, J. Mytych, A. Bilska-Kos, The Presence and Expression of the HIF-1 1α in the Respiratory Intestine of the Bronze Corydoras Corydoras Aeneus (Callichthyidae Teleostei), „Fish Physiology and Biochemistry” 2018, Vol. 44, No. 5, s. 1291–1297, https://doi.org/10.1007/s10695-018-0520-2; L. Satora, K. Kozioł, W. Waldman et al., Differential Expression of Epidermal Growth Factor Receptor (EGFR) in Stomach and Diverticulum of Otocinclus Affinis (Steindachner, 1877) as a Potential Element of the Epithelium Remodeling Mechanism, „Acta Histochemica” 2019, Vol. 121, No. 2, s. 151–155, https://doi.org/10.1016/j.acthis.2018.11.008; L. Satora, J. Mytych, A. Bilska-Kos et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, „Seminars in Cancer Biology” 2020, Vol. 60, s. 362–364, https://doi.org/10.1016/j.semcancer.2019.10.003; Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
- Por. Satora, Histological and Ultrastructural Study, s. 83–86.
- Por. Graham, Air-breathing Fishes; J.A. Nelson, Breaking Wind to Survive: Fishes that Breathe Air with Their Gut, „Journal of Fish Biology” 2014, Vol. 84, No. 3, s. 554–576, https://doi.org/10.1111/jfb.12323.
- Por. Satora, Histological and Ultrastructural Study, s. 83–86.
- Por. Mytych, Kozioł, Satora, Confirmation of the Immunoreactivity of Monoclonal, s. 151–153.
- Por. Nelson, Breaking Wind to Survive, s. 554–576.
- Por. Graham, Air-breathing Fishes; Nelson, Breaking Wind to Survive, s. 554–576.
- Por. Satora, Kozioł, Zebrowski, Squamous Epithelium Formation, s. 563–568; Satora, Mytych, Bilska-Kos, The Presence and Expression of the HIF-1, s. 1291–1297; Satora, Kozioł, Waldman et al., Differential Expression of Epidermal Growth Factor Receptor (EGFR), s. 151–155; Satora, Mytych, Bilska-Kosc et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, s. 362–364; Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
- Por. Mytych, Kozioł, Satora, Confirmation of the Immunoreactivity of Monoclonal, s. 151–153; Satora, Kozioł, Zebrowski, Squamous Epithelium Formation, s. 563–568; Satora, Mytych, Bilska-Kos, The Presence and Expression of the HIF-1, s. 1291–1297; Satora, Kozioł, Waldman et al., Differential Expression of Epidermal Growth Factor Receptor (EGFR), s. 151–155; Satora, Mytych, Bilska-Kosc et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, s. 362–364.
- Por. Mytych, Kozioł, Satora, Confirmation of the Immunoreactivity of Monoclonal, s. 151–153; Satora, Kozioł, Zebrowski, Squamous Epithelium Formation, s. 563–568; Satora, Mytych, Bilska-Kos, The Presence and Expression of the HIF-1, s. 1291–1297; Satora, Kozioł, Waldman et al., Differential Expression of Epidermal Growth Factor Receptor (EGFR), s. 151–155; Satora, Mytych, Bilska-Kosc et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, s. 362–364.
- Por. Satora, Mytych, Bilska-Kos, The Presence and Expression of the HIF-1, s. 1291–1297.
- Por. Satora, Mytych, Bilska-Kos, The Presence and Expression of the HIF-1, s. 1291–1297.
- Por. Graham, Air-breathing Fishes; Icardo, Lungs and Gas Bladders, s. 605–612; Nelson, Breaking Wind to Survive, s. 554–576.
- Por. L.C. Sullivan, C.B. Daniels, I.D. Phillips et al., Conservation of Surfactant Protein A: Evidence for a Single Origin for Vertebrate Pulmonary Surfactant, „Journal of Molecular Evolution” 1998, Vol. 46, No. 2, s. 131–138, https://doi.org/10.1007/pl00006287.
- Por. Satora, Histological and Ultrastructural Study, s. 83–86.
- Por. M. Hofman, B.E. Taylor, M.B. Harris, Evolution of Lung Breathing from a Lungless Primitive Vertebrate, „Respiratory Physiology & Neurobiology” 2016, Vol. 224, s. 11–16, https://doi.org/10.1016/j.resp.2015.09.016.
- Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
- Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
- Por. Graham, Air-breathing Fishes.
- Por. Graham, Air-breathing Fishes.
- Por. H. Chang, Y. Yang, J. Lee et al., Epidermal Growth Factor Receptor Gene Amplification Predicts Worse Outcome in Patients with Surgically Resected Nonadenocarcinoma Lung Cancer, „Clinical Lung Cancer” 2019, Vol. 20, No. 1, s. 7–12, https://doi.org/10.1016/j.cllc.2018.06.003; A. Gröbe, W. Eichhorn, M. Fraederich et al., Immunohistochemical and FISH Analysis of EGFR and Its Prognostic Value in Patients with Oral Squamous Cell Carcinoma, „Journal of Oral & Pathology Medicine” 2014, Vol. 43, No. 3, s. 205–210 https://doi.org/10.1111/jop.12111.
- Por. L. Satora, J. Mytych, A. Bilska-Kos et al., From Epithelial Remodeling to Carcinogenesis, s. 203–205; Satora, Mytych, Bilska-Kosc et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, s. 362–364; C. Sonnenschein, A.M. Soto, Carcinogenesis Explained Within the Context of a Theory of Organisms, „Progress in Biophysics and Molecular Biology” 2016, Vol. 122, No. 1, s. 70–76, https://doi.org/10.1016/j.pbiomolbio.2016.07.004.
- Por. C. Sonnenschein, A.M. Soto, Carcinogenesis Explained, s. 70–76.
- Por. C. Sonnenschein, A.M. Soto, Carcinogenesis Explained, s. 70–76.
- Por. Satora, Mytych, Bilska-Kosc et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, s. 362–364.
- Por. Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
- Por. Mytych, Kozioł, Satora, Confirmation of the Immunoreactivity of Monoclonal, s. 151–153.
- Por. Satora, Kozioł, Zebrowski, Squamous Epithelium Formation, s. 563–568.
- Por. L. Satora, J. Mytych, A. Bilska-Kos et al., From Epithelial Remodeling to Carcinogenesis, s. 203–205; Satora, Mytych, Bilska-Kosc et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, s. 362–364; Satora, Gawlikowski, Tański et al., Quest for Breathing, s. 393–401.
Literatura:
- Chang H., Yang Y., Lee J. et al., Epidermal Growth Factor Receptor Gene Amplification Predicts Worse Outcome in Patients with Surgically Resected Nonadenocarcinoma Lung Cancer, „Clinical Lung Cancer” 2019, Vol. 20, No. 1, s. 7–12, https://doi.org/10.1016/j.cllc.2018.06.003.
- Gould S.J., Ewolucja życia na Ziemi, „Świat Nauki” 1994, nr 12, s. 61–68.
- Gould S.J., Vrba E.S., Exaptation – A Missing Term in the Science of Form, „Paleobiology” 1982, Vol. 8, No. 1, s. 4–15, https://doi.org/10.1017/S0094837300004310.
- Graham J.B., Air-breathing Fishes: Evolution, Diversity and Adaptation, Academic Press, San Diego – London – Boston – New York – Sydney – Tokyo – Toronto 1997.
- Gröbe A., Eichhorn W., Fraederich M. et al., Immunohistochemical and FISH Analysis of EGFR and Its Prognostic Value in Patients with Oral Squamous Cell Carcinoma, „Journal of Oral & Pathology Medicine” 2014, Vol. 43, No. 3, s. 205–210 https://doi.org/10.1111/jop.12111.
- Hofman M., Taylor B.E., Harris M.B., Evolution of Lung Breathing from a Lungless Primitive Vertebrate, „Respiratory Physiology & Neurobiology” 2016, Vol. 224, s. 11–16, https://doi.org/10.1016/j.resp.2015.09.016.
- Icardo J.M., Lungs and Gas Bladders: Morphological Insights, „Acta Histochemica” 2018, Vol. 120, No 7, s. 605–612, https://doi.org/10.1016/j.acthis.2018.08.006.
- Mytych J., Kozioł K., Satora L., Confirmation of the Immunoreactivity of Monoclonal Anti-human C-terminal EGFR Antibodies in Bronze Corydoras Corydoras Aeneus (Callichthyidae Teleostei) by Western Blot Method, „Acta Histochemica” 2018, Vol. 120, No. 2, s. 151–153, https://doi.org/10.1016/j.acthis.2017.12.002.
- Nelson J.A., Breaking Wind to Survive: Fishes that Breathe Air with Their Gut, „Journal of Fish Biology” 2014, Vol. 84, No. 3, s. 554–576, https://doi.org/10.1111/jfb.12323.
- Satora L., Gawlikowski T., Tański A. et al., Quest for Breathing: Proliferation of Alveolar Type 1 Cells, „Histochemistry and Cell Biology” 2022, Vol. 157, No. 4, s. 393–401, https://doi.org/10.1007/s00418-022-02073-5.
- Satora L., Histological and Ultrastructural Study of the Stomach of the Air-breathing Ancistrus Multispinnis (Siluriformes, Teleostei), „Canadian Journal of Zoology” 1998, Vol. 76, No. 1, s. 83–86, https://doi.org/10.1139/z97-167.
- Satora L., Kozioł K., Waldman W. et al., Differential Expression of Epidermal Growth Factor Receptor (EGFR) in Stomach and Diverticulum of Otocinclus Affinis (Steindachner, 1877) as a Potential Element of the Epithelium Remodeling Mechanism, „Acta Histochemica” 2019, Vol. 121, No. 2, s. 151–155, https://doi.org/10.1016/j.acthis.2018.11.008.
- Satora L., Kozioł K., Zebrowski J., Squamous Epithelium Formation in the Respiratory Intestine of the Bronze Corydoras Corydoras Aeneus (Callichthyidae Teleostei), „Acta Histochemica” 2017, Vol. 119, No. 5, s. 563–568, https://doi.org/10.1016/j.acthis.2017.05.010.
- Satora L., Mytych J., Bilska-Kos A. et al., Chemoreceptors as a Key to Understanding Carcinogenesis Process, „Seminars in Cancer Biology” 2020, Vol. 60, s. 362–364, https://doi.org/10.1016/j.semcancer.2019.10.003.
- Satora L., Mytych J., Bilska-Kos A. et al., From Epithelial Remodeling to Carcinogenesis, „Progress in Biophysics and Molecular Biology” 2020, Vol. 150, s. 203–205, https://doi.org/10.1016/j.pbiomolbio.2019.08.001.
- Satora L., Mytych J., Bilska-Kos A., The Presence and Expression of the HIF-1 1α in the Respiratory Intestine of the Bronze Corydoras Corydoras Aeneus (Callichthyidae Teleostei), „Fish Physiology and Biochemistry” 2018, Vol. 44, No. 5, s. 1291–1297, https://doi.org/10.1007/s10695-018-0520-2.
- Sonnenschein C., Soto A.M., Carcinogenesis Explained Within the Context of a Theory of Organisms, „Progress in Biophysics and Molecular Biology” 2016, Vol. 122, No. 1, s. 70–76, https://doi.org/10.1016/j.pbiomolbio.2016.07.004.
- Sullivan L.C., Daniels C.B., Phillips I.D. et al., Conservation of Surfactant Protein A: Evidence for a Single Origin for Vertebrate Pulmonary Surfactant, „Journal of Molecular Evolution” 1998, Vol. 46, No. 2, s. 131–138, https://doi.org/10.1007/pl00006287.
- Szarski H., Historia zwierząt kręgowych, Wydawnictwo Naukowe PWN, Warszawa 2016.
- Tattersall I., Human Evolution and Cognition, „Theory in Biosciences” 2010, Vol. 129, No. 2–3, s. 193–201, https://doi.org/10.1007/s12064-010-0093-9.

