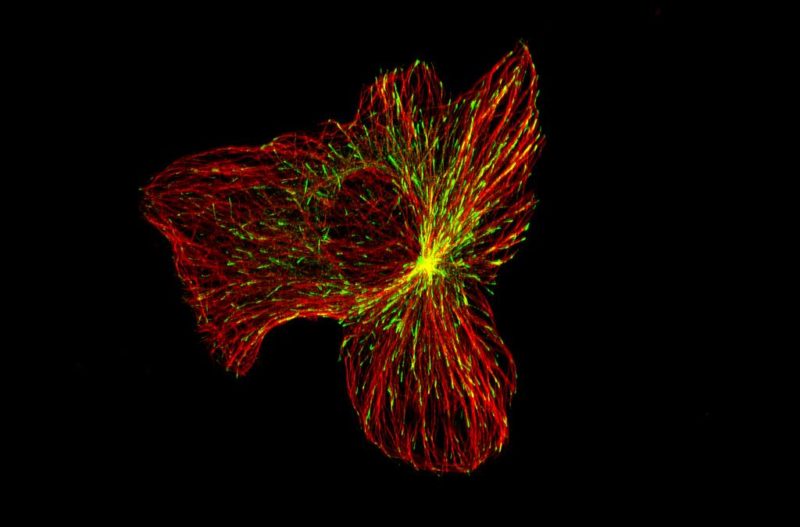
Mikrotubule są głównym składnikiem cytoszkieletu, te silnie wydłużone kompleksy „rurek” o średnicy 20–27 nm odpowiadają w głównej mierze za transport organelli oraz białek, a także za przemieszczanie się, zachowanie kształtu i podział komórki. Większość mikrotubuli ma pochodzenie centrosomalne (przy jądrze), niektóre podzbiory pochodzą jednak od kompleksu Golgiego (aparat Golgiego). Jest to złożona struktura wewnątrz komórki, która przetwarza i transportuje białka oraz lipidy. Dotychczasowe badania ujawniały, że w przeciwieństwie do mikrotubuli centrosomalnych, promieniujących we wszystkich kierunkach, te pochodzące z aparatu Golgiego były ułożone w kierunku przedniej krawędzi migrujących komórek. Naukowcy, chcąc dokonać rozróżnienia funkcji odkrytego zestawu mikrotubuli, ograniczyli ilość tworzących je białek CLASP w migrujących komórkach nabłonka warstwy barwnikowej siatkówki. Dzięki temu mogli zaobserwować fragmentaryczną degenerację struktury kompleksu Golgiego występującego normalnie w kształcie pofałdowanej wstążki1.
Zespół badaczy z Uniwersytetu Vanderbilt zademonstrował, w jaki sposób mikrotubule poruszają się w procesie nieustannej biomechanicznej przebudowy nazywanej mechanizmem bieżni (ang. treadmilling). Komórka ulega polimeryzacji mikrotubuli poprzez dodawanie kolejnych cząsteczek tubuiny lub depolimeryzacji poprzez ich odrywanie. Zrozumienie procesu, w jaki sposób włókna te zużywają energię, rozciągając nieustannie wnętrze komórki lub kurcząc się na poszczególnych jej końcach, może przyczynić się do dalszego postępu wiedzy medycznej. Najnowszy artykuł badaczy opublikowany w czasopiśmie „PNAS” opisuje zbiorowe działanie białek XMAP215, EB1, CLASP2 i MCAK umożliwiających ukierunkowaną przebudowę rusztowania komórki. Za pomocą zaawansowanej mikroskopii Marija Zanic wraz z zespołem badawczym dokonali analizy mikrotubuli poza komórką z dala od ukierunkowujących je białek. W takim układzie poprzez dodawanie różnych białek i odczynników mogli nadzorować dynamikę przebudowy mikrotubuli oraz porównać zmiany procesu w wyniku modelowania komputerowego. Jak się okazało, połączenie tubuliny z czterema innymi białkami sprzyja temu samemu rodzajowi kierowania, jakie występuje naturalnie w komórkach. Jak zapewniają, same mikrotubule poruszały się powolnym ruchem w przeciwnym kierunku, niż obserwujemy w komórkach, jednak po dodaniu określonych białek udało się już zaobserwować cały mechanizm. Interdyscyplinarny projekt z pogranicza biofizyki i biologii molekularnej został dofinansowany przez liczne granty naukowe oraz instytucje związane z rozwojem zdrowia, a lepszy wgląd w ukierunkowanie dynamiki komórki umożliwi opracowanie metod leczenia zapobiegających chorobom degenerującym cytoszkielet, takim jak rak2.
Przemysław Maksymowicz
Źródło zdjęcia: Wikimedia Commons
Ostatnia aktualizacja strony: 20.09.2020
Przypisy
- Por. P.M. Miller et al., Golgi-derived CLASP-dependent Microtubules Control Golgi Organization and Polarized Trafficking in Motile Cells, „Nature Cell Biology” 2009, Vol. 11, No. 9, s. 1069–1080.
- Por. G. Arpağ et al., Collective effects of XMAP215, EB1, CLASP2, and MCAK Lead to Robust Microtubule Treadmilling, „Proceedings of the National Academy of Sciences” 2020, Vol. 117 No. 23, s. 12847–12855 [dostęp 15 IX 2020].