Tak zatytułowałem miniwykład, aby zaintrygować i zaciekawić potencjalnego Czytelnika moją wiedzą i refleksjami na temat śmierci komórek człowieka. Śmierć dotyczy tylko organizmów żywych i trudno sobie wyobrazić większy truizm. Jednak już stwierdzenie, że śmierć komórek jest końcem życia człowieka, nie jest tak oczywiste, bo zmusza nas do szukania przyczyn śmierci komórki. Ile komórek i jakie okoliczności ich śmierci w organizmie mogą doprowadzić do śmierci człowieka?
Pomimo całej dotychczasowej wiedzy biologicznej i medycznej trudno zrozumieć, co rzeczywiście jest przyczyną śmierci człowieka. Niewydolność kluczowych organów, choroby krążenia, nowotwory oraz infekcje mikroorganizmów ‒ to są czynniki dobrze nam znane. Aby zrozumieć śmierć w sensie biologicznym, trzeba ów proces wyjaśnić na poziomie biologii molekularnej.
Nasze ciało składa się z 30–40 trylionów komórek, które nie są jednorodne, bo dzielą się na cztery podstawowe tkanki – łączną, epitelialną, mięśniową i nerwową. Każdą z tych tkanek charakteryzują bardziej wyspecjalizowane komórki. W sumie jest ich około 200 różnych rodzajów. Każda zdrowa komórka jest tak zaprogramowana, że w wyniku sygnałów przesłanych od innych komórek w organizmie może otrzymać rozkaz, aby „popełnić samobójstwo”. Jeżeli jednak któraś z nich nie podporządkuje się rozkazowi, to jej „niesubordynacja” i niekontrolowany podział może doprowadzić do śmierci człowieka.
Wiemy o tym dlatego, że naukowcy oprócz biologicznej istoty życia zaczęli badać również proces śmierci pojedynczych komórek. Historycznie trudno ustalić dokładną datę rozpoczęcia tych obserwacji, bo w nauce często jest tak, że najpierw coś badamy bez poznania szczegółów, a później, czasami po wielu latach, dzięki innym badaniom zaczynamy rozumieć sens tej naukowej układanki. Badania naukowe nierzadko przypominają wyprawę na ryby – nigdy nie wiadomo, co uda się złowić.
Pierwsze morfologiczne badania dotyczące śmierci komórki zostały malowniczo opisane, bo użyto greckiego słowa – apoptoza, co znaczy opadanie liści z drzew. Pojęcie to wprowadzili naukowcy John Kerr, Andrew Wyllie i Alastair Currie w 1972 roku1. Każdy z nas jest świadkiem opadania liści z drzew jesienią, ale mało kto zadaje sobie pytanie, jak to się dzieje. Liście tracą wodę, drzewa gromadzą pobrany z liści magnez, a zielony kolor zmienia się w żółty, czerwony, brązowy. Ogonki nie mają już możliwości utrzymania liści i te opadają. To nie jest niekontrolowany przez drzewo proces, ale aktywne działanie fizjologii drzewa spowodowane zmianą pory roku.
Badania zaprogramowanej śmierci komórki są prowadzone od dawna, ale jakoś nie cieszą się dużym zainteresowaniem społeczeństwa, bo po co sobie głowę zaprzątać śmiercią. Jeśli chcemy znaleźć analogię dla apoptozy, czyli zaprogramowanej śmierci komórki, to wyobraźmy sobie zakończenie pracy starej elektrowni atomowej. Przebieg rozbiórki elektrowni musi być dokładnie zaplanowany. Najpierw trzeba zatrzymać reaktory atomowe, co jest procesem skomplikowanym, opartym na obliczeniach prowadzonych przez symulacje komputerowe.
Dalej postępowanie podzielone jest na trzy fazy. Po zatrzymaniu pracy reaktorów usuwa się materiał radioaktywny i wywozi go ze szczególną ostrożnością w bezpieczne miejsce. Następnie należy przeprowadzić rozbiórkę elektrowni według planu wcześniej zatwierdzonego przez odpowiedni urząd. Trzecim etapem, po końcowej rozbiórce, jest przygotowanie miejsca zajmowanego przez elektrownię do społecznego użytku2.
Każdy z tych trzech etapów składa się z dużej ilości kroków i kroczków, które są realizowane przez specjalistów uzbrojonych w odpowiedni sprzęt i narzędzia. Towarzyszy temu ścisła i określona sekwencja zdarzeń, nie ma tu chaosu i niezaplanowanego przepychania się różnych ekip pracowników między sobą. Wszystko to jest podobne do programowanej śmierci komórki. Analogią dla nekrotycznej śmierci komórki będzie umiejętne założenie ładunków wybuchowych i eksplozja budynku3.
Proces śmierci komórki zaczyna się od naruszenia jej homeostazy. Zachwianie równowagi doprowadza do zaburzenia procesu życia w kierunku nieodwracalnej dekonstrukcji. Działanie przebiega stopniowo, jest wieloetapowe i ostatecznie prowadzi do rozkładu komórki.
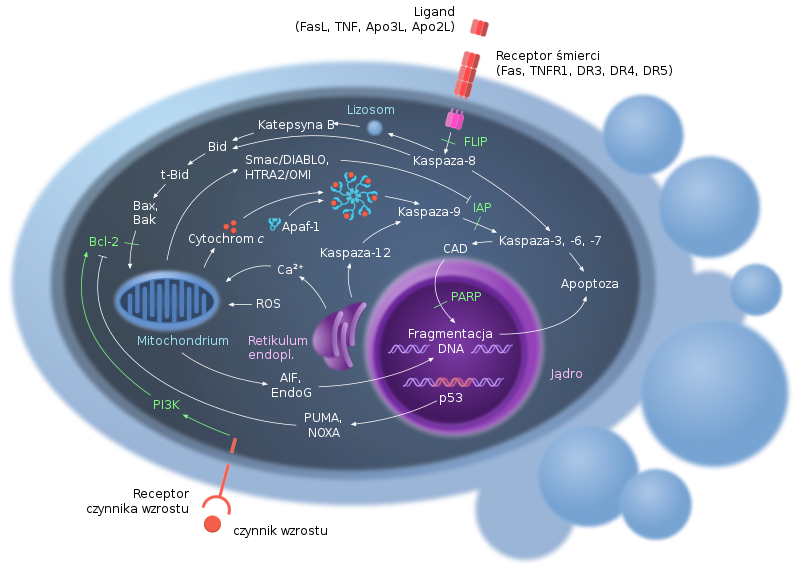
Zacznijmy od jednego z pierwszych etapów tego procesu. Na zewnątrz komórka jest otoczona błoną cytoplazmatyczną, na której znajdują się receptory. Są to białka poruszające się po błonie komórkowej, a to umożliwia im łączenie się z innymi receptorami i tworzenie kompleksów białkowych. Receptory mają nie tylko część wyeksponowaną na zewnątrz komórki, ale drugą część, która znajduje się w jej wnętrzu.
Ten krótki i bardzo pobieżny opis receptora jest konieczny dla zrozumienia mechanizmu działania receptorów śmierci. Ich nazwa intryguje, ale one same bez aktywacji nie powodują śmierci komórki. Mimo że organizm człowieka ma wiele sposobów na zabicie własnych komórek, to tutaj ograniczę się do receptora TNFR14, który jest jak zamek otwierający drzwi dopiero wtedy, kiedy trafi do niego odpowiedni klucz. Bez tego receptora komórka żyje sobie „beztrosko”.
Do uruchomienia zaprogramowanego procesu śmierci komórki potrzeba takiego klucza; w żargonie naukowym jest to ligand, który uruchamia TNFR1. W tym wypadku to cytokina TNF-α5. Wiązanie ligandu z receptorem aktywuje część receptora wewnątrz komórki i rozpoczyna się proces apoptozy. Jeżeli Czytelnik w tym momencie wyobraża sobie, że to już koniec życia komórki, to z całym szacunkiem muszę przyznać, że brakuje mu podstawowej wiedzy z zakresu biologii molekularnej.
Pobudzony receptor TNFR1prowadzi do rekrutacji kilku białek w komórce i utworzenia dwóch białkowych kompleksów TRADD i FADD6. Oba kompleksy prowadzą do aktywacji kaspazy-8. A skąd tu nagle pojawiła się kaspaza-8 i jaką odgrywa rolę? Kaspaza-8 należy do rodziny kaspaz: 2, 3, 6, 7, 8, 9 i 107. Jest jeszcze kilka kaspaz, ale one pełnią inną funkcję w organizmie. Nieaktywne kaspazy, czyli prokaspazy, krążą we wnętrzu komórki i można sobie je wyobrazić jako doktora Jekylla8. Pod wpływem sygnału, który otrzymała komórka do popełnienia samobójstwa, prokaspaza-8 przekształca się w kaspazę-8 w taki sposób, że prokaspaza-8 dzieli się na dwie części i łączy się z drugą tak samo podzieloną cząsteczką prokaspazy-8. Tak powstaje kompleks czterech połączonych ze sobą białek i kaspaza-8 otrzymuje (jak na bierzmowaniu) drugie imię: białko proapoptotyczne – to jest pan Hyde, trzymając się wyżej wspominanej analogii. Kaspaza-8 zmienia prokaspazę-3 na kaspazę-3 w mniej więcej taki sposób, w jaki sama została zmieniona. Zmiana prokaspaz w kaspazy odbywa się kaskadowo i można ją porównać do zmiany żywego człowieka w zombie przez kontakt z… zombie, oczywiście, jeżeli Czytelnik zna filmy o zombie9.
W ten sposób z kaspaz (białek) powstają wysokiej wydajności enzymy zwane proteazami, które rozkładają napotkane białka w komórce. Rozkład białek prowadzi do demontażu fizjologii komórki. Proteazy rozkładają też cytoszkielet10, rusztowanie odpowiedzialne za kształt komórki i zapewniające orientację oraz właściwą lokalizację organelli w cytoplazmie. Komórka traci elastyczność i zapada się w sobie, niczym mocno zestresowany życiem człowiek.
Proces umierania komórki trwa dalej. Ważnymi organellami są mitochondria, które żyjącej komórce dostarczają energię. Trzeba je rozmontować niczym elektrownię atomową: w sposób ściśle zaprogramowany. Rozbrojenie mitochondriów prowadzi do wytworzenia w błonie mitochondrialnej kanału nazwanego MAC (z ang. Mitochondrial Apoptosis-Induced Channel)11. Żeby proces śmierci komórki jeszcze bardziej skomplikować, to ten kanał wykształca się poprzez połączenie kilku białek BAK. Powstały kanał powoduje uwolnienie cytochromu C z mitochondrium. Rola cytochromu C polega na syntezie cząsteczek ATP, które są źródłem życiowej energii. Wydostanie się cytochromu C z mitochondrium wygasza produkcję energii – światło zanika.
W tym momencie białko przestaje pełnić swoją funkcję niczym elektrownia pozbawiona paliwa. Pozostała ostatnia faza – wymazanie centrum informatycznego komórki, coś w rodzaju sformatowania dysku stacjonarnego w komputerze.
W programowanej śmierci komórki fragmentacja DNA przez lata była ikoną apoptozy. DNA wielkości trzech miliardów par zasad w jądrze komórkowym człowieka jest uporządkowane w taki sposób, żeby komórka miała natychmiastowy dostęp do każdej potrzebnej jej informacji. To uporządkowanie polega na tym, że sekwencje DNA owinięte są wokół rdzenia złożonego z 8 białek histonowych (podobnie jak nitka nawinięta na szpulce). Struktura ta nazywa się nukleosomem i stanowi podstawową jednostkę w komórkach eukariotycznych. Rozmontowywanie składu informacji odbywa się szybko, ale w sposób wysoce zorganizowany. Istotną funkcję pełnią tutaj enzymy hydrolityczne znane jako deoksyrybonukleazy (DNazy)12, czyli enzymy tnące DNA na krótkie fragmenty. Skąd one się tam wzięły? W procesie apoptozy, kaspaza-3 uaktywnia DNazy i ze względu na swoją funkcję jest nazwana CAD (Caspase-3 Activated DNase)13. Doprowadza ona do pocięcia DNA na fragmenty w miejscach wrażliwych na enzym, a więc tam, gdzie sekwencja DNA nie jest chroniona przez nukleosomy.
To jeszcze nie jest końcowa faza śmierci komórki, bo trzeba pozbyć się denata. Jeżeli uświadomimy sobie, że miliardy komórek w naszym ciele umierają z różnych powodów każdego dnia, to posprzątanie resztek po wymarłych komórkach stanowi problem na wagę zdrowia naszego organizmu.
Przez cały okres uśmiercania komórki błona komórkowa ulega zniekształceniu, co prowadzi do rozpadu komórki na małe pęcherzyki, aż w końcu komórka przestaje być rozpoznawalna pod mikroskopem. Pęcherzyki nie powinny tak pozostać, bo zanieczyszczają środowisko i mogą się okazać toksyczne dla sąsiednich komórek. Zasadniczo są to „śmieci”, których należy się pozbyć (czyli zachodzi tutaj pewien rodzaj recyklingu). W procesie sprzątania bierze udział zespół komórek złożony z profesjonalnych, nieprofesjonalnych i wysoce wyspecjalizowanych fagocytów14. I tutaj, niczym na cmentarzu, kończy się zaprogramowana śmierć komórek – requiescat in pace.
Wcześniej użyłem sformułowania proapoptotyczne białka. To jest jedna strona medalu. Druga ‒ to białka antyapoptotyczne. Jaka jest ich rola? Białka te utrzymują większą stabilność komórki i zapobiegają, aby pojedynczy sygnał śmierci wysłany do jej wnętrza przesądzał o losie komórki. Jednak białka antyapoptotyczne funkcjonują niczym miecz obosieczny. Co się dzieje, jeżeli regulacja tego białka wymyka się spod kontroli komórki? Wtedy komórka staje się „rebeliantem” odpornym na zaprogramowaną śmierć i całkowicie blokuje proces apoptozy.
Takie zjawisko zostało zaobserwowane wiele lat temu. Wymknięcie się apoptozy spod kontroli organizmu może prowadzić do rozwoju komórek nowotworowych. Komórki układu immunologicznego wysyłają „wyrok śmierci” komórkom nowotworowym, a one sobie z tego nic nie robią. Stają się „nieśmiertelne”, co paradoksalnie może prowadzić do śmierci człowieka.
Przykładem jest białko antyapoptotyczne Bcl-215. Mutacja genu może prowadzić do nieustającej produkcji tego białka. Zostało to zaobserwowane w przewlekłych białaczkach. Obraz to ponury, ale na szczęście firmy farmaceutyczne wyprodukowały inhibitor, który blokuje funkcję białka Bcl-216 i komórki białaczkowe umierają masowo, a to daje pacjentowi szansę na dłuższe życie.
Opisany tutaj szlak metaboliczny prowadzący do apoptozy jest jednym z wielu znanych takich szlaków. Warto też wiedzieć, że na samej apoptozie nie kończy się zjawisko zaprogramowanej śmierci komórki. Zaobserwowano, zbadano i opisano kilka innych zaprogramowanych procesów śmierci komórek, z których wymienię tylko trzy. Nekroptoza, wcześniej była uważana za przypadkową i niefizjologiczną śmierć (nazwana nekrozą), ale przy dokładniejszym badaniu okazało się, że jest to zaprogramowany proces śmierci, stąd „optoza”17.
Dwie inne formy zaprogramowanej śmierci komórki to pyroptoza18 i autofagia19. Pyroptoza jest wysoce zapalną formą zaprogramowanej śmierci, która występuje w mikrośrodowisku komórek zarażonych patogenem. Natomiast autofagia to proces, w którym komórka zjada sama siebie, co na pierwszy rzut oka wygląda jak kolejny paradoks w biologii, ale i tutaj przy dokładnych badaniach odnaleziono biologiczne uzasadnienie, na przykład odchudzanie człowieka będącego na głodówce.
***
Wiedza naukowa to nie tylko świadectwa naukowe, ale również ich interpretacja. Kto ma być odpowiedzialny za interpretację świadectw naukowych? Wydawać by się mogło, że jest to rola naukowców, którzy gromadzą dane naukowe. Tak jednak to nie działa, bo dane biologiczne są zawsze podporządkowane powszechnie przyjętej teorii ewolucji. Wypada zapytać: czy ewolucyjna interpretacja uzyskanej informacji na temat apoptozy mieści się w mechanizmach ewolucji? Proces ewolucji „decyduje”, że przeżyć i wydać potomstwo mogą tylko lepiej przystosowane do życia osobniki danej populacji, a dzieje się tak dzięki przypadkowym mutacjom w DNA, które są selekcjonowane przez dobór naturalny. Wobec tego zaprogramowany proces śmierci komórek powstał dzięki osobnikom lepiej przystosowanym do… życia. Jako biolog i wieloletni naukowiec prestiżowych placówek naukowych na świecie nie zgadzam się z tak absurdalnym wyjaśnieniem powstania apoptozy, którą wymuszają na biologach ewolucjoniści.
Na koniec, parafrazując znaną wypowiedź Richarda Dawkinsa z 1989 roku, mogę powiedzieć – oczywiście nie obrażając nikogo – że jeżeli ktoś nadal, pomimo licznych danych empirycznych, wierzy, że ewolucyjna narracja jest w stanie wytłumaczyć obecne i przyszłe odkrycia biologii molekularnej, to jest „niewykształcony, tępy lub pomylony”20.
Od autora:
W opisie zaprogramowanej śmierci komórki obszernie posłużyłem się analogiami do codziennego życia człowieka. To często stosowany chwyt antropomorficzny, który dla lepszego zrozumienia wyników badań naukowych opisuje zjawiska w kategoriach naszego codziennego życia. Nie jest to idealna metoda przedstawienia danych naukowych. Uczyniłem tak jednak w celach dydaktycznych, aby Czytelnicy mało obeznani w badaniach biologii molekularnej mogli zrozumieć choć w zarysie procesy zachodzące w żywej komórce.
Ann Arbor, MI, 2 września 2020
Andrzej Myc
Źródło zdjęcia: Wikipedia
Ostatnia aktualizacja strony: 11.09.2020
Przypisy
- Por. J.F. Kerr, A.H. Wyllie, A.R. Currie, Apoptosis: A Basic Biological Phenomenon With Wide-Ranging Implications in Tissue Kinetics, „British Journal of Cancer” 1972, Vol. 26, No. 4, s. 239–257.
- Por. Backgrounder on Decommissioning Nuclear Power Plants, „U.S. Nuclear Regulatory Commission” [dostęp 2 IX 2020].
- Nagranie z tego zdarzenia można zobaczyć: Satisfying Building Demolition, Controlled Explosion [dostęp 2 IX 2020].
- Por. Tumor Necrosis Factor Receptor 1, „Wikipedia” [dostęp 2 IX 2020].
- Por. Cytokines, „ScienceDirect” [dostęp 2 IX 2020].
- Por. H. Hsu et al., TRADD–TRAF2 and TRADD–FADD Interactions Define Two Distinct TNF Receptor 1 Signal Transduction Pathways, „Cell” 1996, Vol. 84, No. 2, s. 299‒308 [dostęp 2 IX 2020].
- Por. Caspase, „Wikipedia” [dostęp 2 IX 2020].
- Co jest oczywistym nawiązaniem do książki Roberta Louisa Stevensona Niezwykły przypadek doktora Jekkyla i pana Hyde’a, Warszawa 2008.
- Por. Top 25 Zombie Movies of All Time, „IMDb” [dostęp 2 IX 2020].
- Por. Cytoskeleton, „Wikipedia” [dostęp 2 IX 2020].
- Por. Mitochondrial Apoptosis-induced Channel, „Wikipedia” [dostęp 2 IX 2020].
- Por. Deoxyribonuclease, „Wikipedia” [dostęp 2 IX 2020].
- Por. Apoptotic DNA Fragmentation, „Wikipedia” [dostęp 2 IX 2020].
- Por. Phagocyte, „Wikipedia” [dostęp 2 IX 2020].
- Por. Bcl-2, „Wikipedia” [dostęp 2 IX 2020].
- Por. An Oral Therapy to Help You Fight Certain Blood Cancers, „Venclexta” [dostęp 2 IX 2020].
- Więcej na temat tego fascynującego procesu umierania komórki można przeczytać: Necroptosis, „Wikipedia”.
- Por. Pyroptosis, „Wikipedia” [dostęp 2 IX 2020].
- Więcej na temat procesu „samozjadania się” komórki można przeczytać tu: Autophagy, „Wikipedia” [dostęp 2 IX 2020].
- Cyt za: K. Jodkowski, Zasadnicza nierozstrzygalność sporu ewolucjonizm-kreacjonizm, „Przegląd Filozoficzny – Nowa Seria” 2012, R. 21, nr 3(83), s. 205 [201‒222] [dostęp 2 IX 2020].
Literatura:
- An Oral Therapy to Help You Fight Certain Blood Cancers, „Venclexta” [dostęp 2 IX 2020].
- Apoptotic DNA Fragmentation, „Wikipedia” [dostęp 2 IX 2020].
- Autophagy, „Wikipedia” [dostęp 2 IX 2020].
- Backgrounder on Decommissioning Nuclear Power Plants, „U.S. Nuclear Regulatory Commission” [dostęp 2 IX 2020].
- Bcl-2, „Wikipedia” [dostęp 2 IX 2020].
- Caspase, „Wikipedia” [dostęp 2 IX 2020].
- Cytokines, „ScienceDirect” [dostęp 2 IX 2020].
- Cytoskeleton, „Wikipedia” [dostęp 2 IX 2020].
- Deoxyribonuclease, „Wikipedia” [dostęp 2 IX 2020].
- Hsu H. et al., TRADD–TRAF2 and TRADD–FADD Interactions Define Two Distinct TNF Receptor 1 Signal Transduction Pathways, „Cell” 1996, Vol. 84, No. 2, s. 299‒308 [dostęp 2 IX 2020].
- Jodkowski K., Zasadnicza nierozstrzygalność sporu ewolucjonizm-kreacjonizm, „Przegląd Filozoficzny – Nowa Seria” 2012, R. 21, nr 3(83), s. 205 [201‒222] [dostęp 2 IX 2020].
- Kerr J.F., Wyllie A.H., Currie A.R., Apoptosis: A Basic Biological Phenomenon With Wide-Ranging Implications in Tissue Kinetics, „British Journal of Cancer” 1972, Vol. 26, No. 4, s. 239–257.
- Mitochondrial Apoptosis-induced Channel, „Wikipedia” [dostęp 2 IX 2020].
- Necroptosis, „Wikipedia” ” [dostęp 2 IX 2020].
- Phagocyte, „Wikipedia” [dostęp 2 IX 2020].
- Pyroptosis, „Wikipedia” [dostęp 2 IX 2020].
- Satisfying Building Demolition, Controlled Explosion [dostęp 2 IX 2020].
- Top 25 Zombie Movies of All Time, „IMDb” [dostęp 2 IX 2020].
- Tumor Necrosis Factor Receptor 1, „Wikipedia” [dostęp 2 IX 2020].