Na blogu „Evolution News & Science Today” opublikowałem wcześniej kilka artykułów na temat niesamowitego projektu i wyśmienitej inżynierii cyklu podziału komórkowego u eukariontów1. Ostatnio w czasopiśmie „BIO-Complexity” opublikowałem również artykuł, w którym przedstawiłem poważne problemy dla tezy o powstaniu cyklu komórkowego u eukariontów wskutek działania procesów ewolucyjnych (jest on dostępny nieodpłatnie w internecie)2. W niniejszym artykule opiszę kilka aspektów cyklu komórkowego, które decydują o jego nieredukowalnej złożoności (tę kwestię także poruszam w artykule).
Kondensyny
Kondensyny to kompleksy białkowe, które odgrywają kluczową rolę w organizacji i segregacji chromosomów w trakcie podziału komórkowego. Kondensyny są wysoce utrwalone pośród eukariontów. Kondensyna I jest aktywna podczas profazy i przyczynia się do zachowania strukturalnej integralności chromosomów po rozpadzie otoczki jądrowej. Kondensyna II jest aktywna wcześniej w profazie i bierze udział w początkowych etapach kondensacji chromosomów w jądrze.
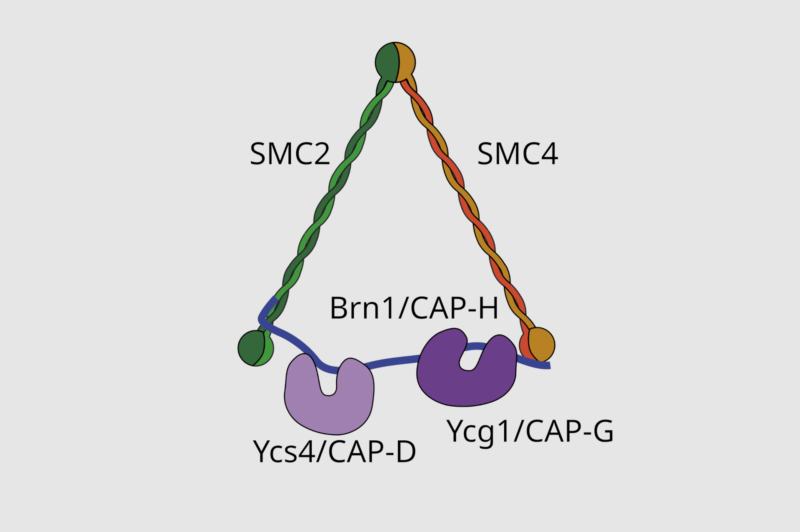
Cząsteczki kondensyny składają się z pięciu podjednostek (zobacz ilustrację), wliczając w to białka SMC (structural maintenance of chromosomes) – SMC2 i SMC4, które wykazują aktywność ATPazy. Białka SMC mają domeny coiled-coil (czyli długie, elastyczne ramiona, które zawijają się na siebie, tworząc strukturę w kształcie litery V); region zawiasowy ułatwiający dimeryzację dwóch białek SMC oraz domeny główne mające miejsca wiązania ATP i ATPazy, czyli cząsteczek stanowiących źródło energii dla aktywności kondensyn. Są też trzy podjednostki niebędące białkami SMC, łączące się ze specyficznymi regionami DNA i wspomagające regulację aktywności kondensyn.
Kompleksy kondensynowe są kierowane przez podjednostki niebędące białkami SMC i przedostają się do chromatyny stopniowo, wskutek czego tworzą się pętle DNA (energii dla tego procesu dostarczają białka wykazujące aktywność ATPazy). Pętle DNA ulegają następnie skondensowaniu w chromosomy mitotyczne.
Kondensyny są niezbędne do zajścia podziału komórkowego. Następstwem ich braku byłaby dezorganizacja chromosomów, jak również ogromna trudność prawidłowego rozdzielenia ich w trakcie mitozy.
Kinetochory
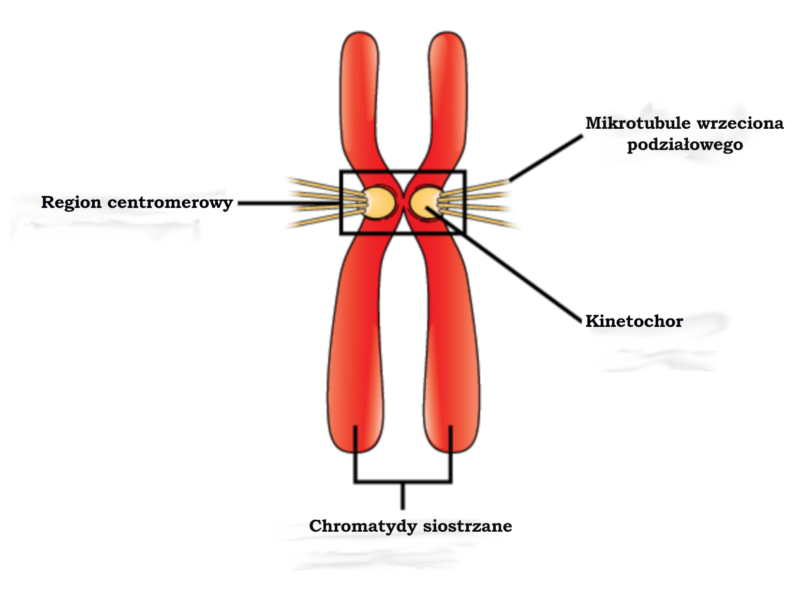
Kompleks białek nazywany kinetochorem gromadzi się wokół centromeru każdego chromosomu (zobacz ilustrację) i odgrywa kluczową rolę w procesie mitotycznego podziału komórkowego. Każdy kinetochor służy jako miejsce przyłączenia mikrotubul wrzeciona podziałowego, które wychodzą z centromerów przy biegunach komórki. Kinetochory pomagają w procesie przyrównania chromosomów w płaszczyźnie równika komórki w trakcie metafazy, dzięki czemu gwarantowane jest równe rozdzielenie materiału genetycznego. Kinetochory wyczuwają również napięcie generowane przez przyciąganie mikrotubul i w rezultacie zapewniają prawidłowe przyłączenie. Jeśli dojdzie do nieprawidłowych przyłączeń (na przykład jeśli kinetochory obu chromatyd siostrzanych zostaną przyłączone do tego samego bieguna), to te błędy mogą zostać naprawione przez maszynerię powiązaną z kinetochorem.
Co by się stało, gdyby nie było kinetochorów? Doszłoby do nieprawidłowego przyłączenia chromosomów do wrzeciona podziałowego, a materiał genetyczny zostałby nierówno rozdzielony do komórek potomnych. W gruncie rzeczy kinetochory są tak kluczowe dla procesu podziału komórkowego, że występują powszechnie u wszystkich znanych organizmów eukariotycznych.
Separaza i kompleks promujący anafazę
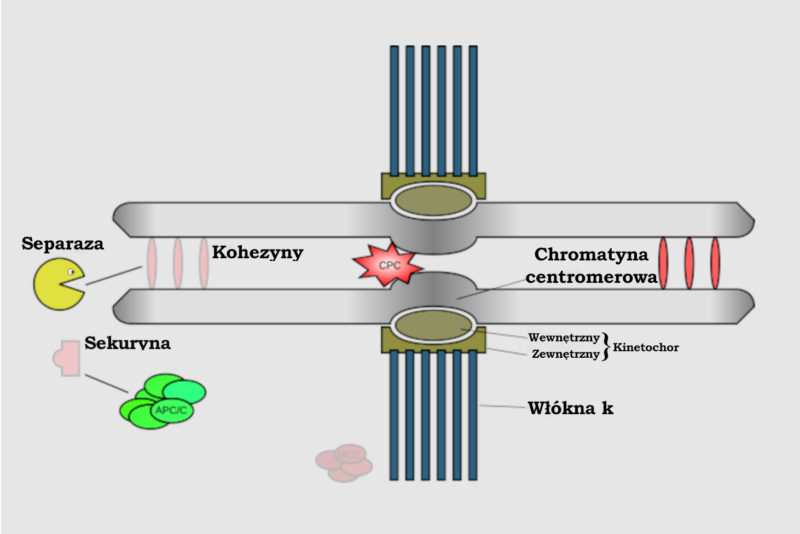
W przejściu od metafazy do anafazy pośredniczy kompleks promujący anafazę lub cyklosom (APC/C – anaphase promoting complex/cyclosome), czyli ligaza ubikwitynowa E3. Gdy APC/C wiąże się ze swoim koaktywatorem, Cdc20, prowadzi do ubikwitynacji sekuryny (białka zapobiegającego cięciu kohezyny przez enzym separazę). Ubikwitynacja sekuryny funkcjonuje jako oznaczenie, że ma być ona zniszczona przez molekularną niszczarkę w komórce, czyli proteasom. Dzięki temu enzym separaza może pociąć pierścień kohezynowy, który łączy ze sobą chromatydy siostrzane, i zainicjować w ten sposób rozdzielenie chromatyd siostrzanych.
Przy braku separazy chromatydy siostrzane nie mogłyby się rozdzielić, a komórka nie byłaby w stanie przeprowadzić segregacji chromosomów w trakcie anafazy. W gruncie rzeczy za pomocą eksperymentów polegających na wyciszaniu genów wykazano, że usunięcie separazy skutkuje śmiercią zarodków3. Postęp cyklu komórkowego byłby wstrzymany również przy braku APC/C, ponieważ wówczas nie doszłoby do przejścia od metafazy do anafazy. Na przykład wyciszenie APC2 (kluczowej podjednostki APC/C) u myszy w toku eksperymentu poskutkowało wystąpieniem nieprawidłowości szpiku kostnego w ciągu zaledwie siedmiu dni4.
Kinazy Aurora
Kinazy Aurora także są kluczowe dla prawidłowego tworzenia się wrzeciona podziałowego i segregacji chromosomów. Kinaza Aurora A fosforyluje białka biorące udział w procesie organizacji mikrotubul i ułatwia prawidłowe przyłączenie mikrotubul do kinetochorów. W gruncie rzeczy „myszy pozbawione kinazy Aurora A umierają na wczesnych w etapach rozwoju zarodkowego w stadium liczącym 16 komórek. U zarodków pozbawionych kinazy Aurora A nieprawidłowo zachodzi mitoza – dotyczy to zwłaszcza tworzenia się wrzeciona podziałowego. Świadczy to o tym, że kinaza Aurora A pełni kluczowe funkcje w trakcie mitozy”5. Oznacza to, że kinaza Aurora A jest jednym ze składników, które są niezbędne do prawidłowego zajścia podziału komórkowego.
Mikrotubule
W innym artykule opisałem kluczową rolę mikrotubul w podziale komórkowym6. Mikrotubule wychodzą z centrosomów i zakotwiczają się w kompleksie kinetochoru, który tworzy się wokół centromeru każdego chromosomu. W trakcie metafazy chromosomy układają się wzdłuż płaszczyzny równika komórki, wiążąc się z mikrotubulami w kinetochorze. W anafazie chromatydy siostrzane są odciągane przez siebie przez mikrotubule wskutek działania sił związanych z wrzecionem podziałowym, które są skierowane w stronę biegunów komórki. Mikrotubule są więc niezbędne do rozdzielenia chromatyd siostrzanych do dwóch komórek potomnych.
Przy braku mikrotubul proces tworzenia wrzeciona podziałowego byłby poważnie upośledzony, utrudniając przyrównanie i segregację chromosomów. W eksperymentach na zarodkach myszy pozbawionych tubuliny γ wykazano, że w ich przypadku mitoza zostaje wstrzymana, przez co zahamowaniu ulega proces rozwoju w stadiach moruli i blastocysty7.
Pierścień kurczliwy
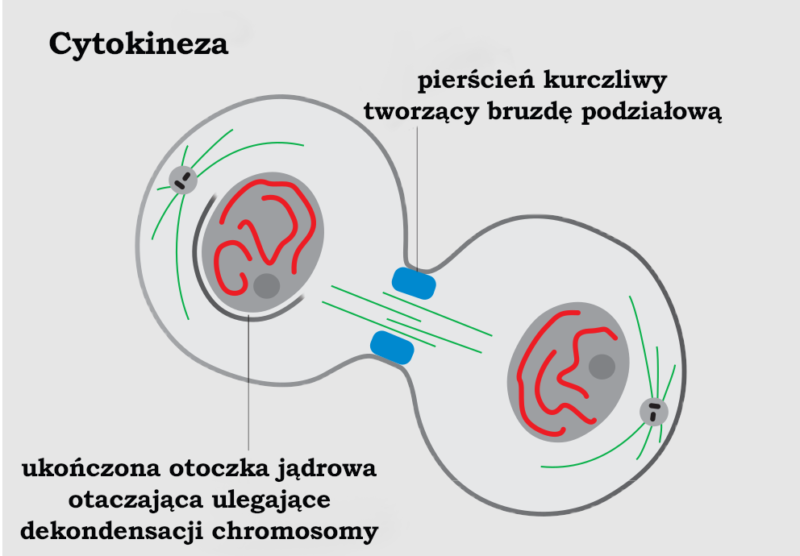
Pierścień kurczliwy jest kluczowy dla procesu cytokinezy, czyli ostatniego stadium mitozy, w którym komórka dokonuje fizycznego podziału na dwie komórki potomne. Pierścień kurczliwy zasadniczo składa się z filamentów aktyny i białek motorycznych nazywanych miozynami II oraz innych białek regulatorowych, takich jak forminy (RhoA) i septyny. Te elementy tworzą dynamiczną, przypominającą pasek strukturę znajdującą się pod błoną przy równiku dzielącej się komórki. Pierścień kurczliwy generuje siłę potrzebną do ingresji bruzdy podziałowej. Tę powodującą kurczenie siłę generują miozyny II w momencie wejścia w interakcje z filamentami aktyny. Źródła energii dla tego procesu dostarcza hydroliza ATP. Gdy pierścień się zaciska, błona cytoplazmatyczna obkurcza się, co ostatecznie prowadzi do podziału cytoplazmy. Brak pierścienia kurczliwego skutkuje tym, że komórka nie dokonuje podziału, co prowadzi do utworzenia komórek z dwoma jądrami oraz do innych nieprawidłowości.
Białka motoryczne
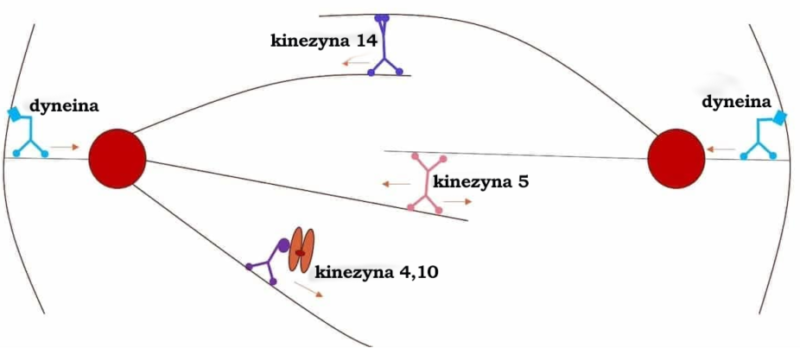
W innym artykule opisałem rolę białek motorycznych (kinezyny i dyneiny) w tworzeniu i funkcjonowaniu wrzeciona podziałowego w trakcie podziału komórkowego u eukariontów8. Zainteresowanych czytelników zachęcam do przeczytania mojego artykułu w celu zapoznania się z opisem tego zdumiewającego procesu. Brak tych białek motorycznych poważnie zakłóciłby proces transportu i pozycjonowania chromosomów, co szłoby w parze z nieprawidłowym przyrównaniem chromosomów podczas metafazy oraz problemami z utworzeniem prawidłowego wrzeciona podziałowego. W rezultacie prowadziłoby to do nieprawidłowej segregacji chromosomów w stadium anafazy.
Cząsteczki Cdk i cykliny
W innym artykule pisałem o roli kinaz cyklinozależnych i cząsteczek cykliny w procesie podziału komórkowego9. Zachęcam czytelników do przeczytania tego artykułu w celu zapoznania się ze szczegółami. Cząsteczki Cdk i cykliny cechują się redundancją, co oznacza, że nie wszystkie są indywidualnie niezbędne. Na przykład myszy, u których wyciszono Cdk2, Cdk3, Cdk4 lub Cdk6, pozostają zdolne do życia10. Co więcej, komórki drożdży mają tylko jedną Cdk, a konkretnie Cdk111. Co ciekawe, podwójne wyciszenia kombinacji Cdk2 i Cdk4 albo Cdk4 i Cdk6 prowadzą do śmierci zarodków, chociaż takiego efektu nie przynosi podwójne wyciszenie Cdk2 i Cdk612. Okazuje się więc, że para Cdk2 i Cdk4 oraz para Cdk4 i Cdk6 mogą wzajemnie się zastępować13. Cdk1 wydaje się jednak niezbędna, ponieważ jej wyciszenie hamuje proces rozwoju w stadium blastocysty14.
Cząsteczki Cdk są aktywowane poprzez związanie się z cząsteczkami cykliny. Przy braku cyklin Cdk byłyby nieaktywne, a cykl komórkowy uległby zahamowaniu. Mimo że w tym przypadku również mamy do czynienia z redundancją (czyli nie wszystkie cykliny są niezbędne do prawidłowego zajścia podziału komórkowego), brak cykliny B (która aktywuje Cdk1, dzięki czemu może zajść mitoza) uniemożliwiłby przejście od fazy G2 do fazy M. Inaczej mówiąc, komórka nie mogłaby rozpocząć procesu mitozy. Potwierdzają to wyniki eksperymentów polegających na wyciszeniu cykliny B w zarodkach myszy, co doprowadziło do zahamowania cyklu komórkowego w fazie G2 już po zaledwie dwóch podziałach15.
Punkty kontrolne
W innych artykułach pisałem o różnych punktach kontrolnych w cyklu komórkowym – to jest o punkcie kontrolnym G1 (związanym z ograniczaniem), punkcie kontrolnym G2 (związanym z uszkodzeniami DNA) oraz o punkcie kontrolnym związanym z tworzeniem wrzeciona podziałowego16. One także są niezbędne do prawidłowego zajścia cyklu komórkowego. Na przykład przy braku kompleksu będącego punktem kontrolnym mitozy komórka utraciłaby zdolność do monitorowania procesu tworzenia wrzeciona podziałowego, co drastycznie zwiększałoby ryzyko, że komórki będą dokonywały podziału przy nieprawidłowym działaniu wrzeciona podziałowego. Skutkiem tego byłaby nieprawidłowa segregacja chromosomów i aneuploidia. Przy braku punktu kontrolnego G1 w fazę S mógłby wejść uszkodzony DNA, co mogłoby doprowadzić do rozprzestrzenienia się mutacji oraz do niestabilności genomu. Utrata punktu kontrolnego G2 umożliwiłaby udział uszkodzonego DNA w procesie mitozy, co skutkowałoby podziałem komórek zawierających nienaprawiony materiał genetyczny, jak również znacznie zwiększałoby ryzyko aberracji chromosomów. Przy braku punktu kontrolnego związanego z uszkodzeniami DNA w fazie S dochodziłoby do replikacji uszkodzonego DNA, co skutkowałoby rozprzestrzenieniem się mutacji i zwiększeniem ryzyka wystąpienia nieprawidłowości genetycznych w komórkach potomnych.
Nieredukowalna złożoność
Jak wskazuje mój zwięzły opis, różne elementy układu mitotycznego podziału komórkowego są niezbędne do jego funkcjonowania. W związku z tym należy uznać, że podział komórkowy u eukariontów jest nieredukowalnie złożony, a przez to stanowi problem dla wyjaśnień powołujących się na ślepe procesy ewolucyjne. Powstanie każdego układu, który realizuje jakiś złożony cel wyższego rzędu za sprawą wzajemnego oddziaływania licznych dobrze dopasowanych składników, wymaga dalekowzroczności. W kolejnym artykule pokażę, że ewolucjonistyczne wyjaśnienia powstania procesu podziału komórkowego u eukariontów borykają się z jeszcze poważniejszym problemem.
Jonathan McLatchie
Oryginał: The Eukaryotic Cell Cycle: An Irreducibly Complex System, „Evolution News & Science Today” 2024, November 26 [dostęp: 28 V 2025].
Przekład z języka angielskiego: Dariusz Sagan
Przypisy
- Linki do wcześniejszych tekstów na ten temat można znaleźć w artykule: J. McLatchie, New Paper Challenges Evolutionary Account of the Eukaryotic Cell Cycle, „Evolution News & Science Today” 2024, November 11 [dostęp: 13 IV 2025].
- Por. tenże, Phylogenetic Challenges to the Evolutionary Origin of the Eukaryotic Cell Cycle, „BIO-Complexity” 2024, No. 4, s. 1–19, https://doi.org/10.5048/BIO-C.2024.4.
- Por. K. Kumada et al., The Selective Continued Linkage of Centromeres from Mitosis to Interphase in the Absence of Mammalian Separase, „Journal of Cell Biology” 2006, Vol. 172, No. 6, s. 835–846, https://doi.org/10.1083/jcb.200511126; K.G. Wirth et al., Separase: A Universal Trigger for Sister Chromatid Disjunction but not Chromosome Cycle Progression, „Journal of Cell Biology” 2006, Vol. 172, No. 6, s. 847–860, https://doi.org/10.1083/jcb.200506119.
- Por. J. Wang et al., APC/C Is Essential for Hematopoiesis and Impaired in Aplastic Anemia, „Oncotarget” 2017, Vol. 8, No. 38, s. 63360–63369, https://doi.org/10.18632/oncotarget.18808.
- L.Y. Lu et al., Aurora A Is Essential for Early Embryonic Development and Tumor Suppression, „Journal of Biological Chemistry” 2008, Vol. 283, No. 46, s. 31785 [31785–31790], https://doi.org/10.1074/jbc.m805880200.
- Por. J. McLatchie, Astounding: The Role of Motor Proteins in Cell Division, „Evolution News & Science Today” 2024, May 8 [dostęp: 14 IV 2025].
- Por. A. Yuba-Kubo et al., Gene Knockout Analysis of Two Gamma-Tubulin Isoforms in Mice, „Developmental Biology” 2005, Vol. 282, No. 2, s. 361–373, https://doi.org/10.1016/j.ydbio.2005.03.031.
- Por. J. McLatchie, Astounding: The Role of Motor Proteins in Cell Division.
- Por. tenże, How the Eukaryotic Cell Cycle Is Controlled, „Evolution News & Science Today” 2013, June 17 [dostęp: 14 IV 2025].
- Por. C. Berthet et al., Cdk2 Knockout Mice Are Viable, „Current Biology” 2003, Vol. 13, No. 20, s. 1775–1785, https://doi.org/10.1016/j.cub.2003.09.024; S. Ortega et al., Cyclin-Dependent Kinase 2 Is Essential for Meiosis but not for Mitotic Cell Division in Mice, „Nature Genetics” 2003, Vol. 35, No. 1, s. 25–31, https://doi.org/10.1038/ng1232; X. Ye, C. Zhu, J.W. Harper, A Premature-Termination Mutation in the Mus musculus Cyclin-Dependent Kinase 3 Gene, „Proceedings of the National Academy of Sciences USA” 2001, Vol. 98, No. 4, s. 1682–1686, https://doi.org/10.1073/pnas.98.4.1682; S.G. Rane et al., Loss of Cdk4 Expression Causes Insulin-Deficient Diabetes and Cdk4 Activation Results in β-Islet Cell Hyperplasia, „Nature Genetics” 1999, Vol. 22, No. 1, s. 44–52, https://doi.org/10.1038/8751; T. Tsutsui et al., Targeted Disruption of CDK4 Delays Cell Cycle Entry with Enhanced p27Kip1 Activity, „Molecular and Cellular Biology” 1999, Vol. 19, No. 10, s. 7011–7019, https://doi.org/10.1128/mcb.19.10.7011; M.G. Hu et al., A Requirement for Cyclin-Dependent Kinase 6 in Thymocyte Development and Tumorigenesis, „Cancer Research” 2009, Vol. 69, No. 3, s. 810–818, https://doi.org/10.1158/0008-5472.can-08-2473; M. Malumbres et al., Mammalian Cells Cycle without the D-Type Cyclin-Dependent Kinases Cdk4 and Cdk6, „Cell” 2004, Vol. 118, No. 4, s. 493–504, https://doi.org/10.1016/j.cell.2004.08.002.
- Por. J.M. Enserink, R.D. Kolodner, An Overview of Cdk1-Controlled Targets and Processes, „Cell Division” 2010, Vol. 5, numer artykułu: 11, https://doi.org/10.1186/1747-1028-5-11.
- Por. M. Malumbres et al., Mammalian Cells Cycle without the D-Type Cyclin-Dependent Kinases Cdk4 and Cdk6; C. Berthet, P. Kaldis, Cell-Specific Responses to Loss of Cyclin-Dependent Kinases, „Oncogene” 2007, Vol. 26, No. 31, s. 4469–4477, https://doi.org/10.1038/sj.onc.1210243.
- Por. A. Satyanarayana, P. Kaldis, Mammalian Cell-Cycle Regulation: Several Cdks, Numerous Cyclins and Diverse Compensatory Mechanisms, „Oncogene” 2009, Vol. 28, No. 33, s. 2925–2939, https://doi.org/10.1038/onc.2009.170.
- Por. M.K. Diril et al., Cyclin-Dependent Kinase 1 (Cdk1) Is Essential for Cell Division and Suppression of DNA Re-Replication but not for Liver Regeneration, „Proceedings of the National Academy of Sciences USA” 2012, Vol. 109, No. 10, s. 3826–3831, https://doi.org/10.1073/pnas.1115201109.
- Por. C. Berthet et al., Combined Loss of Cdk2 and Cdk4 Results in Embryonic Lethality and Rb Hypophosphorylation, „Developmental Cell” 2006, Vol. 10, No. 5, s. 563–573, https://doi.org/10.1016/j.devcel.2006.03.004; B. Strauss et al., Cyclin B1 Is Essential for Mitosis in Mouse Embryos, and Its Nuclear Export Sets the Time for Mitosis, „Journal of Cell Biology” 2018, Vol. 217, No. 1, s. 179–193, https://doi.org/10.1083/jcb.201612147.
- Por. J. McLatchie, The Cell’s Surveillance System: Introducing the Cell Cycle Checkpoint Pathways, „Evolution News & Science Today” 2013, August 6 [dostęp: 14 IV 2025]; tenże, The Elegant Spindle Assembly Checkpoint, „Evolution News & Science Today” 2024, August 26 [dostęp: 14 IV 2025]; tenże, Engineered Elegance: Generating the Wait Anaphase Signal, „Evolution News & Science Today” 2024, August 27 [dostęp: 14 IV 2025].
Literatura:
1. Berthet C. et al., Cdk2 Knockout Mice Are Viable, „Current Biology” 2003, Vol. 13, No. 20, s. 1775–1785, https://doi.org/10.1016/j.cub.2003.09.024.
2. Berthet C. et al., Combined Loss of Cdk2 and Cdk4 Results in Embryonic Lethality and Rb Hypophosphorylation, „Developmental Cell” 2006, Vol. 10, No. 5, s. 563–573, https://doi.org/10.1016/j.devcel.2006.03.004.
3. Berthet C., Kaldis P., Cell-Specific Responses to Loss of Cyclin-Dependent Kinases, „Oncogene” 2007, Vol. 26, No. 31, s. 4469–4477, https://doi.org/10.1038/sj.onc.1210243.
4. Diril M.K. et al., Cyclin-Dependent Kinase 1 (Cdk1) Is Essential for Cell Division and Suppression of DNA Re-Replication but not for Liver Regeneration, „Proceedings of the National Academy of Sciences USA” 2012, Vol. 109, No. 10, s. 3826–3831, https://doi.org/10.1073/pnas.1115201109.
5. Enserink J.M., Kolodner R.D., An Overview of Cdk1-Controlled Targets and Processes, „Cell Division” 2010, Vol. 5, numer artykułu: 11, https://doi.org/10.1186/1747-1028-5-11.
6. Hu M.G. et al., A Requirement for Cyclin-Dependent Kinase 6 in Thymocyte Development and Tumorigenesis, „Cancer Research” 2009, Vol. 69, No. 3, s. 810–818, https://doi.org/10.1158/0008-5472.can-08-2473.
7. Kumada K. et al., The Selective Continued Linkage of Centromeres from Mitosis to Interphase in the Absence of Mammalian Separase, „Journal of Cell Biology” 2006, Vol. 172, No. 6, s. 835–846, https://doi.org/10.1083/jcb.200511126.
8. Lu L.Y. et al., Aurora A Is Essential for Early Embryonic Development and Tumor Suppression, „Journal of Biological Chemistry” 2008, Vol. 283, No. 46, s. 31785–31790, https://doi.org/10.1074/jbc.m805880200.
9. Malumbres M. et al., Mammalian Cells Cycle without the D-Type Cyclin-Dependent Kinases Cdk4 and Cdk6, „Cell” 2004, Vol. 118, No. 4, s. 493–504, https://doi.org/10.1016/j.cell.2004.08.002.
10. McLatchie J., Astounding: The Role of Motor Proteins in Cell Division, „Evolution News & Science Today” 2024, May 8 [dostęp: 14 IV 2025].
11. McLatchie J., Engineered Elegance: Generating the Wait Anaphase Signal, „Evolution News & Science Today” 2024, August 27 [dostęp: 14 IV 2025].
12. McLatchie J., How the Eukaryotic Cell Cycle Is Controlled, „Evolution News & Science Today” 2013, June 17 [dostęp: 14 IV 2025].
13. McLatchie J., New Paper Challenges Evolutionary Account of the Eukaryotic Cell Cycle, „Evolution News & Science Today” 2024, November 11 [dostęp: 13 IV 2025].
14. McLatchie J., Phylogenetic Challenges to the Evolutionary Origin of the Eukaryotic Cell Cycle, „BIO-Complexity” 2024, No. 4, s. 1–19, https://doi.org/10.5048/BIO-C.2024.4.
15. McLatchie J., The Cell’s Surveillance System: Introducing the Cell Cycle Checkpoint Pathways, „Evolution News & Science Today” 2013, August 6 [dostęp: 14 IV 2025].
16. McLatchie J., The Elegant Spindle Assembly Checkpoint, „Evolution News & Science Today” 2024, August 26 [dostęp: 14 IV 2025].
17. Ortega S. et al., Cyclin-Dependent Kinase 2 Is Essential for Meiosis but not for Mitotic Cell Division in Mice, „Nature Genetics” 2003, Vol. 35, No. 1, s. 25–31, https://doi.org/10.1038/ng1232.
18. Rane S.G. et al., Loss of Cdk4 Expression Causes Insulin-Deficient Diabetes and Cdk4 Activation Results in β-Islet Cell Hyperplasia, „Nature Genetics” 1999, Vol. 22, No. 1, s. 44–52, https://doi.org/10.1038/8751.
19. Satyanarayana A., Kaldis P., Mammalian Cell-Cycle Regulation: Several Cdks, Numerous Cyclins and Diverse Compensatory Mechanisms, „Oncogene” 2009, Vol. 28, No. 33, s. 2925–2939, https://doi.org/10.1038/onc.2009.170.
20. Strauss B. et al., Cyclin B1 Is Essential for Mitosis in Mouse Embryos, and Its Nuclear Export Sets the Time for Mitosis, „Journal of Cell Biology” 2018, Vol. 217, No. 1, s. 179–193, https://doi.org/10.1083/jcb.201612147.
21. Tsutsui T. et al., Targeted Disruption of CDK4 Delays Cell Cycle Entry with Enhanced p27Kip1 Activity, „Molecular and Cellular Biology” 1999, Vol. 19, No. 10, s. 7011–7019, https://doi.org/10.1128/mcb.19.10.7011.
22. Wang J. et al., APC/C Is Essential for Hematopoiesis and Impaired in Aplastic Anemia, „Oncotarget” 2017, Vol. 8, No. 38, s. 63360–63369, https://doi.org/10.18632/oncotarget.18808.
23. Wirth K.G. et al., Separase: A Universal Trigger for Sister Chromatid Disjunction but not Chromosome Cycle Progression, „Journal of Cell Biology” 2006, Vol. 172, No. 6, s. 847–860, https://doi.org/10.1083/jcb.200506119.
24. Ye X., Zhu C., Harper J.W., A Premature-Termination Mutation in the Mus musculus Cyclin-Dependent Kinase 3 Gene, „Proceedings of the National Academy of Sciences USA” 2001, Vol. 98, No. 4, s. 1682–1686, https://doi.org/10.1073/pnas.98.4.1682.
25. Yuba-Kubo A. et al., Gene Knockout Analysis of Two Gamma-Tubulin Isoforms in Mice, „Developmental Biology” 2005, Vol. 282, No. 2, s. 361–373, https://doi.org/10.1016/j.ydbio.2005.03.031.