Cechą zjawisk biologicznych, która od dawna przykuwa moją uwagę, jest rekurencyjna logika projektowa występująca nawet w systemach, które nie wyglądają na powiązane wspólnym pochodzeniem. Ta cecha jest całkiem zaskakująca przy założeniu, że za powstawanie form życia odpowiada pozbawiony umysłu proces, ale jest do przewidzenia w świetle hipotezy, zgodnie z którą ważną rolę w tym procesie odegrał umysł. Kiedy w innych obszarach doświadczenia mamy do czynienia z rekurencyjną logiką projektową, zwykle łączymy ją z działaniem przyczyn inteligentnych. Na przykład obrazy mają cechy charakteryzujące dzieło jakiegoś konkretnego malarza, a budynki mają cechy wspólne dla projektów tego samego architekta. Pewne cechy pisma są też charakterystyczne dla danego autora. Jest to więc przykład przewidywania formułowanego w świetle hipotezy celowego projektu, a więc przykład czegoś, czego zaobserwowania oczekujemy przy założeniu działania obdarzonego inteligencją umysłu. W przyrodzie ożywionej istnieje wiele przykładów tego rodzaju zjawisk. W celach ilustracyjnych skoncentruję się tutaj na jednym ogólnym przykładzie rekurencyjnej logiki projektowej – dwustopniowych systemach regulacji u bakterii.
Czym są dwustopniowe systemy regulacji?
Komórki bakteryjne wykorzystują systemy dwustopniowe do wyczuwania zmian środowiskowych i reagowania na nie. Jak wskazuje ich nazwa, systemy dwustopniowe składają się z dwóch elementów – kinazy sensorowej i regulatora odpowiedzi. Kinaza sensorowa, w odpowiedzi na bodziec chemiczny lub fizyczny, przechodzi autofosforylację polegającą na tym, że grupa fosforanowa jest przenoszona z ATP do reszty histydynowej w kinazie. Kinaza histydynowa ma dwie domeny: domenę wejściową i domenę przekaźnikową. Ta pierwsza znajduje się na zewnętrznej części komórki i jest idealnie umiejscowiona tak, aby mogła wykrywać sygnały nadchodzące ze środowiska. Druga domena znajduje się na cytoplazmatycznej powierzchni błony komórkowej i jest umiejscowiona tak, aby mogła wchodzić w interakcje z regulatorem odpowiedzi. Grupa fosforanowa jest przenoszona do regulatora odpowiedzi, który wywołuje następnie odpowiedź komórki – na przykład włączenie lub wyłączenie genów.
Systemy dwustopniowe występują u bakterii nadzwyczaj często, a każdy z nich wykorzystuje taką samą podstawową logikę projektową. W dalszej części artykułu dokonam krótkiego przeglądu kilku tego typu przykładów.
Regulacja białek błony zewnętrznej u Escherichia coli
System dwuskładnikowy reguluje ekspresję poryn w odpowiedzi na osmolarność środowiska (osmolarność to miara stężenia cząstek rozpuszczonych w roztworze). Kinazą sensorową dla tego systemu, zlokalizowaną w błonie wewnętrznej, jest EnvZ. EnvZ wykrywa zmiany osmolarności i przechodzi autofosforylację. Regulator odpowiedzi, OmpR, otrzymuje grupę fosforanową od EnvZ i reguluje ekspresję genów.
Gdy osmolarność jest wysoka, w EnvZ inicjowana jest aktywność kinazy, co skutkuje fosforylacją OmpR. Gdy osmolarność jest natomiast niska, w EnvZ inicjacji ulega aktywność fosfatazy, co prowadzi do redukcji poziomów uległego fosforylacji OmpR.
Po przejściu fosforylacji OmpR staje się aktywnym dimerem, który wzmacnia zdolność do wiązania DNA specyficzną dla promotorów genów ompC i ompF. Są to geny kodujące poryny, czyli białka błony zewnętrznej (umożliwiają one przechodzenie metabolitów przez zewnętrzną błonę bakterii Gram-ujemnych). Średnica porów zbudowanych z białek OmpF jest większa od średnicy porów utworzonych z białek OmpC. Dzięki temu pory utworzone z OmpF mają dziesięciokrotnie większą szybkość dyfuzji, co daje przewagę w warunkach niskiej osmolarności, kiedy składników pokarmowych jest niewiele. Jeśli ciśnienie osmotyczne jest niskie, to rośnie stopień ekspresji białek OmpF. Jeśli natomiast ciśnienie osmotyczne jest wysokie, to rośnie stopień ekspresji białek OmpC. Co więcej, rozpoczyna się transkrypcja RNA antysensownego micF. RNA micF blokuje translację genów ompF za sprawą tworzenia wiązań komplementarnych, a w związku z tym represji ulega synteza białek OmpF.
Regulacja chemotaksji
Bakterie potrafią poruszać się w kierunku źródła pożywienia, takiego jak glukoza, dzięki procesowi nazywanemu chemotaksją. Warunkiem wstępnym działania tego procesu jest zdolność bakteryjnego silnika wiciowego do dosłownie rozumianej zmiany biegów, dzięki czemu silnik może przechodzić od obrotów niezgodnych z ruchem wskazówek zegara do obrotów z tym ruchem zgodnych. Zmiana obrotów jest dokonywana w odpowiedzi na bodźce chemiczne docierające z otoczenia komórki. Sygnały chemiczne są wykrywane przez dwustopniowy obwód transdukcji sygnałów, który indukuje zmiany obrotów silnika wiciowego.
W zrozumieniu dalszych opisów pomóc czytelnikowi może następujący diagram:
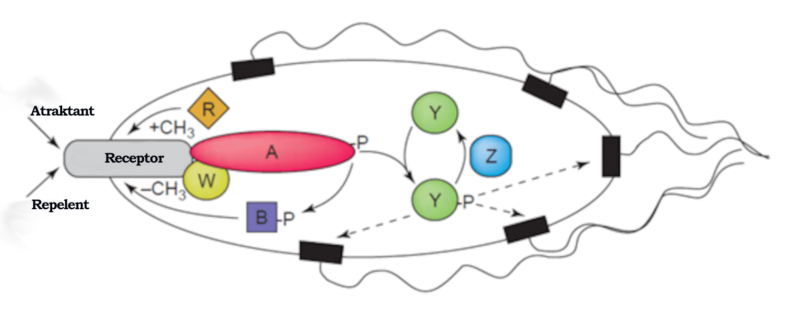
Jak bakterie wykrywają gradient chemiczny? Odpowiedź znajdujemy w pewnej klasie receptorów transbłonowych nazywanych białkami chemotaktycznymi akceptującymi metyl (MCP – methyl-accepting chemotaxis proteins). Różne MCP potrafią wykrywać różne typy cząsteczek i mogą wiązać się z atraktantami lub repelentami. Następnie te receptory komunikują się z tak zwanymi białkami Che i je aktywują.
Białka nazywane CheA i CheW wiążą się z receptorem. CheA to kinaza histydynowa dla tego systemu. Po aktywacji receptora utrwalona reszta histydynowa CheA przechodzi autofosforylację. Istnieją dwa regulatory odpowiedzi określane mianem CheB i CheY. Do ich utrwalonej reszty asparaginianowej przenoszona jest grupa fosforanowa z CheA. CheY następnie oddziałuje z wiciowym białkiem przełącznikowym FliM, co indukuje przełączenie obrotów silnika wiciowego z niezgodnych na zgodne z ruchem wskazówek zegara.
Obroty zgodne z ruchem wskazówek zegara zakłócają działanie całego układu wiciowego i powodują jego zatrzymanie, a bakteria zaczyna „opadać”, ale z powrotem włącza obroty niezgodne z ruchem wskazówek zegara. Bakteria potrafi zmieniać kierunek swojego ruchu oraz wielokrotnie oceniać i dostosowywać go w odpowiedzi na bodźce środowiskowe, takie jak obecność pożywienia lub toksyn.
Co robi inny wspomniany przeze mnie regulator odpowiedzi – CheB? Gdy CheB ulega aktywacji przez kinazę histydynową CheA, funkcjonuje jako metyloesteraza. Oznacza to, że aktywnie usuwa ona grupy metylowe z reszt glutaminianowych znajdujących się na cytoplazmatycznej powierzchni receptora. W międzyczasie inne białko (nazywane CheR) aktywnie dodaje reszty metylowe do tych samych reszt glutaminianowych, a więc funkcjonuje jako metyloesteraza.
W tym momencie możemy dostrzec genialną inżynierię tego procesu. Jeśli bodziec jest silny, to odpowiednio maleje stopień fosforylacji białka CheA, a w rezultacie również regulatorów odpowiedzi CheY i CheB. Pamiętajmy, że rolą CheB jest usuwanie grup metylowych z reszt glutaminianowych znajdujących się na cytoplazmatycznej powierzchni receptora. Teraz jednak uległe fosforylacji białko CheB nie jest dostępne i nie spełnia swojej funkcji. Rośnie więc stopień metylacji białek MCP. Gdy MCP ulegną pełnej metylacji, komórka będzie pływać bez przerwy, ponieważ MCP nie będą już odpowiadały na bodźce.
W związku z tym stopień fosforylacji CheA i CheB wzrośnie, nawet wtedy, gdy wysoki będzie poziom atraktanta, a komórka zacznie opadać. Teraz jednak uległe fosforylacji białko CheB jest w stanie demetylować MCP, a receptory znów mogą odpowiadać na przyciągające sygnały chemiczne. W przypadku repelentów sytuacja jest podobna – z tą różnicą, że MCP w najmniejszym stopniu uległe metylacji odpowiadają najsłabiej, a MCP w pełni uległe metylacji odpowiadają najsilniej. Ten rodzaj regulacji wskazuje też, że bakteria dysponuje systemem umożliwiającym zapamiętywanie stężeń chemicznych z nieodległej przeszłości i porównuje je z aktualnie otrzymywanymi sygnałami. Bakteria potrafi więc wykrywać, czy porusza się w stronę bodźca chemicznego, czy się od niego oddala.
Wyczuwanie liczebności
Celem procesu wyczuwania liczebności (quorum sensing) jest zasadniczo zagwarantowanie, że dostateczna liczba komórek danego gatunku będzie obecna, zanim rozpocznie się proces odpowiedzi, który wymaga, aby zagęszczenie populacji przekraczało pewien określony próg. Jeśli tylko jedna komórka bakteryjna będzie wydzielała toksynę do organizmu eukariotycznego, to najprawdopodobniej nie wyrządzi mu żadnej szkody i tylko zmarnuje swoje zasoby. Jeśli jednak wszystkie komórki bakteryjne w dużej populacji w skoordynowany sposób będą wydzielać toksynę, to wzrośnie prawdopodobieństwo uzyskania pożądanego skutku.
Każdy gatunek wykorzystujący proces wyczuwania liczebności – dotyczy to większości bakterii Gram-ujemnych i niektórych bakterii Gram-dodatnich – syntetyzuje maleńką cząsteczkę sygnałową (fachowo nazywaną „autoinduktorem”), która ulega swobodnej dyfuzji przez błonę komórkową. Autoinduktory są specyficzne dla gatunku, co oznacza, że każda komórka tego samego gatunku produkuje taką samą cząsteczkę. To z kolei oznacza, że autoinduktor znajduje się wewnątrz komórki w wysokim stężeniu tylko wówczas, gdy w pobliżu jest wiele komórek tego samego gatunku. We wnętrzu komórki autoinduktor wiąże się z białkiem aktywacyjnym, które jest specyficzne dla tej konkretnej cząsteczki i sygnalizuje bakterii, że ma rozpocząć transkrypcję specyficznych genów.
Rozważmy na przykład przypadek bakterii bioluminescencyjnej Aliivibrio fischeri. Światło emitowane przez ten gatunek bakterii jest skutkiem działania enzymu nazywanego lucyferazą. Białko aktywacyjne nazywane LuxR odpowiada za kontrolowanie operonów lux, które są z kolei odpowiedzialne za transkrypcję białek wymaganych do luminescencji. Te operony są indukowane, gdy stężenie autoinduktora specyficznego dla Aliivibrio fischeri osiąga dostatecznie wysoki poziom. Ten autoinduktor sam jest syntetyzowany przez enzym kodowany przez gen LuxI.
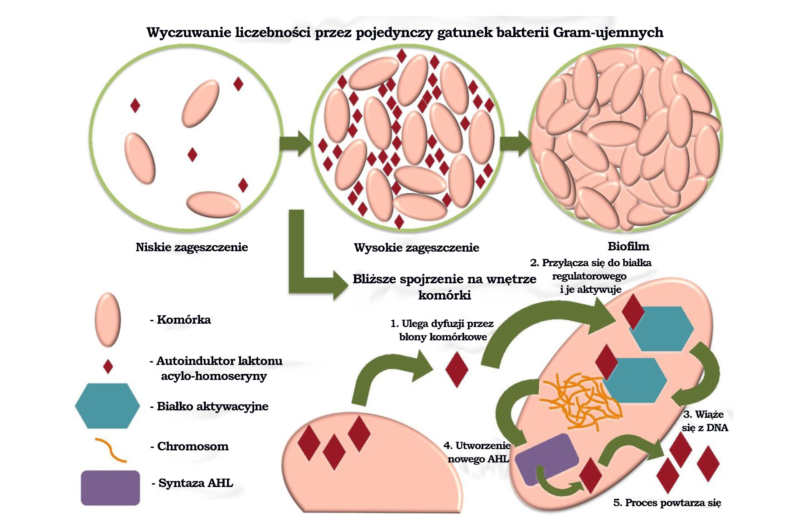
Proces wyczuwania liczebności występuje bardzo często, zwłaszcza u bakterii Gram-ujemnych. Na przykład Pseudomonas aeruginosa wykorzystuje takie procesy „próbkowania populacji” do włączania ekspresji znaczącej liczby niepowiązanych ze sobą genów, gdy populacja osiąga pewien określony próg. Dzięki tym genom komórki mogą następnie tworzyć biofilm (który wzmacnia patogenność organizmu i zapobiega przedostaniu się antybiotyków). Na powyższej ilustracji przedstawiono rolę dwustopniowego procesu wyczuwania liczebności w tworzeniu bakteryjnego biofilmu.
Rekurencyjna logika projektowa
W niniejszym artykule opisałem tylko kilka przykładów dwustopniowych systemów regulacji, a takie przykłady można mnożyć. W przypadku tych różnych systemów dostrzegamy rekurencyjną logikę projektową, pomimo tego, że te systemy nie są powiązane ze sobą ewolucyjnym pochodzeniem. Tego właśnie możemy się spodziewać, jeśli ten sam obdarzony inteligencją umysł był zaangażowany w proces ich tworzenia, ale jest to naprawdę mocno zaskakujące przy przyjęciu, że za powstanie tych systemów odpowiada jakiś niekierowany proces działający na zasadzie przypadku i fizycznej konieczności.
Jonathan McLatchie
Oryginał: Recurring Design Logic in Gene Regulation, „Evolution News & Science Today” 2025, January 24 [dostęp: 8 VIII 2025].
Przekład z języka angielskiego: Dariusz Sagan